Cáncer Testicular: Diagnóstico, Estadificación y Tratamiento.

Los tumores de células germinales representan el 95% de los casos de cáncer testicular, se dividen uniformemente en seminomas y no seminomatosos y rara vez se presentan antes de la pubertad. Revisamos a continuación su diagnóstico, estadificación y tratamiento. El resto de tumores testiculares están conformados por tumores del estroma de los cordones sexuales, que incluyen a los de células de Leydig y Sertoli, y el gonadoblastoma. Otros tumores que se presentan en los testículos son el linfoma, tumores carcinoides y carcinoma metastásico.
Epidemiología del Cáncer Testicular
Aunque el cáncer testicular representa solo el 1% de todos los cánceres en hombres, es la neoplasia maligna sólida más común en varones entre los 15 y 35 años de edad. La incidencia de cáncer testicular aumenta significativamente en hombres con criptorquidia, y aproximadamente el 10% se producen en este contexto. La orquidopexia reduce la probabilidad de malignidad, aunque la edad óptima para la cirugía es incierta.
En adultos, tanto los seminomas como los tumores no seminomatosos pueden estar precedidos por una afección premaligna denominada neoplasia de células germinales in situ (GCNIS), anteriormente denominada neoplasia intratubular de células germinales de tipo no clasificado (IGCNU). Si no se trata la GCNIS, el riesgo de progresión a malignidad invasiva es aproximadamente del 50% en cinco años. No está claro si todos los casos de GCNIS finalmente progresan a una neoplasia invasiva.
Existen otros factores hormonales y genéticos probablemente asociados a un mayor riesgo de cáncer testicular, pero parecen tener sólo un impacto limitado en la incidencia total.
Criptorquidia
Los hombres con antecedentes de criptorquidia y orquidopexia previa tienen un mayor riesgo de cáncer testicular en ambos testículos (mayor en el no descendido), aunque dicho riesgo, en comparación con los hombres en la población general, está poco cuantificado. Por tanto, la autoexploración testicular es una parte importante de la evaluación rutinaria. Debido a la rareza de tales tumores, no está indicada la ecografía escrotal en el seguimiento (en ausencia de hallazgos en exámenes clínicos).
Así se presenta tu paciente
El cáncer testicular generalmente se presenta como un nódulo indoloro de un testículo, que puede ser notado incidentalmente por el paciente. Ocasionalmente, el paciente con un testículo atrófico previamente pequeño notará su agrandamiento. Aproximadamente del 30 al 40% de los pacientes refieren dolor sordo o sensación de pesadez en la parte inferior del abdomen, el área perianal o el escroto, mientras que el dolor agudo es el síntoma de presentación en el 10% de los casos.
En otro 10%, las manifestaciones de presentación del cáncer testicular son atribuibles a la enfermedad metastásica. Los síntomas varían con el sitio de metástasis:
- Una masa en el cuello (metástasis a ganglios linfáticos supraclaviculares).
- Tos o disnea (metástasis pulmonares).
- Anorexia, náuseas, vómitos o hemorragia gastrointestinal (metástasis retroduodenal).
- Lumbalgia (enfermedad retroperitoneal voluminosa que afecta el músculo psoas o las raíces nerviosas).
- Dolor óseo (metástasis esqueléticas).
- Síntomas del sistema nervioso central o periférico (compromiso cerebral, de la médula espinal o raíz periférica).
- Inflamación de la extremidad inferior unilateral o bilateral (obstrucción venosa ilíaca o cava o trombosis)
La ginecomastia, que se presenta en aproximadamente el 5% de los hombres con tumores de células germinales, es una manifestación endocrina sistémica de estas neoplasias. También ocurre en 20 a 30% de los pacientes con tumores de células de Leydig.
Tumores del Estroma de los Cordones Sexuales
Los tumores de células de Leydig representan únicamente el 2% de los tumores en el cáncer testiculares y solo el 10% son malignos. Su presentación clínica está dominada por los síntomas derivados del exceso de estrógenos y testosterona baja. Existe una distribución bimodal de estos tumores; se diagnostican en niños de 6 a 10 años de edad con pubertad precoz, y en hombres de 26 a 35 años de edad con una masa testicular, ginecomastia, impotencia y pérdida de la libido.
Los tumores de células de Sertoli son incluso menos frecuentes y también se presentan con síntomas derivados del exceso de estrógenos.
Ginecomastia
La ginecomastia suele estar asociada a la producción de gonadotropina coriónica humana (hCG) por focos de coriocarcinoma o células trofoblásticas en el tumor. Sin embargo, la relación entre la ginecomastia, la morfología del tumor testicular y las anomalías endocrinas sigue sin estar completamente definida. En algunos pacientes, la ginecomastia puede o no estar asociada a concentraciones séricas elevadas de hCG, lactógeno placentario humano, prolactina, estrógenos o andrógenos.
Otras manifestaciones del Cáncer Testicular
Los pacientes con una marcada sobreproducción de hCG pueden desarrollar otra complicación endocrina, el hipertiroidismo paraneoplásico. La hormona estimulante de la tiroides (TSH) y la hCG tienen una subunidad alfa en común y una subunidad beta con una homología considerable. Como resultado, la hCG tiene actividad estimulante débil de la tiroides. Los pacientes con cáncer testicular rara vez desarrollan una encefalitis límbica paraneoplásica. La mayoría de estos pacientes tienen anticuerpos anti-Ma2 (también llamados anti-Ta). El antígeno Ma2 se expresa selectivamente en los nucleolos neuronales del tejido cerebral normal y el tumor testicular del paciente.
Evaluación del Paciente
Cualquier masa sólida y firme dentro del testículo se considera cáncer testicular hasta no demostrar lo contrario. El diagnóstico y tratamiento oportunos ofrecen la mejor oportunidad de curación. Sin embargo, múltiples factores contribuyen al retraso en el diagnóstico. Por ejemplo, las masas escrotales indoloras a veces se ignoran, mientras que los tumores testiculares que se presentan con dolor escrotal a menudo se tratan como epididimitis.
El diagnóstico diferencial de una masa testicular incluye torsión testicular o epididimitis. Otros trastornos menos comunes incluyen hidrocele, varicocele, hernia, hematoma, espermatocele o goma sifilítica. En los pacientes en los que el diagnóstico no está claro o en los que un hidrocele impide una evaluación adecuada, los estudios de imagen son el siguiente paso para determinar la etiología.
Exploración Física en el Cáncer Testicular
La exploración física de los testículos debe comenzar con la exploración bimanual del contenido del escroto, comenzando con el testículo contralateral normal. Esto permite apreciar el tamaño relativo, el contorno y la consistencia del testículo normal como referencia y comparar con la gónada sospechosa. El testículo debe palparse con cuidado entre el pulgar y los dos primeros dedos de la mano. La gónada normal es de consistencia homogénea, se puede mover libremente y separar del epidídimo. Cualquier área firme, dura o fija dentro de la sustancia de la túnica albugínea debe considerarse sospechosa hasta que se demuestre lo contrario.
La evaluación adicional del lado afectado debe dirigirse hacia la posible participación del cordón espermático, el escroto o la piel. Los tumores testiculares tienden a permanecer ovoides, limitados por la túnica albugínea resistente. Sin embargo, la diseminación al epidídimo o cordón espermático ocurre en 10 a 15% de los pacientes. En general, un seminoma tiende a expandirse dentro del testículo como un agrandamiento indoloro y gomoso, mientras que un carcinoma embrionario o teratocarcinoma forma una masa irregular con bordes indiscretos. Sin embargo, esta distinción no siempre es fácil de apreciar.
Puede haber hidrocele, lo que dificulta la evaluación de un tumor testicular sospechoso. En tales casos, la ecografía escrotal es una técnica rápida y confiable para excluir un hidrocele o epididimitis. Este estudio está indicado en cualquier hombre con sospecha de tumor testicular. La exploración física también debe incluir la palpación del abdomen en busca de evidencia de linfadenopatías o afectación visceral. La evaluación rutinaria de los ganglios linfáticos supraclaviculares puede revelar adenopatía en hombres con enfermedad avanzada. La evaluación del tórax puede revelar ginecomastia o aumentar la sospecha de afectación torácica.
Estudios que serán de utilidad
La evaluación diagnóstica de los hombres con sospecha de cáncer testicular incluye una ecografía escrotal seguida de TAC toracoabdominal, medición de marcadores tumorales séricos, orquiectomía inguinal radical y, en algunos casos, linfadenectomía retroperitoneal. Los resultados se utilizan para determinar el tipo histológico y la extensión de la enfermedad, y para guiar el tratamiento.
La biopsia testicular no se realiza como parte de la evaluación debido a que puede dar lugar a la siembra del tumor en el saco escrotal o la diseminación metastásica del tumor a los ganglios inguinales. Además, dado que la gran mayoría de estos pacientes son hombres jóvenes, se debe considerar el problema de la infertilidad, así como la crioconservación de espermatozoides durante la evaluación diagnóstica inicial.
Ecografía Escrotal en la Evaluación Inicial del Cáncer Testicular
La ecografía escrotal bilateral puede distinguir las lesiones intrínsecas testiculares de las extrínsecas con un alto grado de precisión; además, es posible detectar lesiones intratesticulares tan pequeñas como de 1 a 2 mm de diámetro. En los hombres con masas testiculares, la ecografía escrotal se ha convertido en una extensión de la exploración física, pero nunca debe considerarse un sustituto de esta última. Es poco probable que una masa quística represente malignidad.
En comparación, los seminomas aparecen como lesiones hipoecoicas bien definidas sin áreas quísticas, mientras que los tumores de células germinales no seminomatosos son típicamente heterogéneos, con calcificaciones, áreas quísticas y márgenes indistintos. Sin embargo, esta distinción no siempre es aparente. Incluso la resonancia magnética (RMN) no mejora la especificidad. Otra limitación es que debido a que la túnica albugínea es difícil de discernir mediante ecografía, la estadificación del tumor localizado ha demostrado ser poco confiable con esta técnica.
Por tanto, la ecografía escrotal no puede reemplazar la orquiectomía inguinal radical para la determinación de la histología y el estadio. El uso generalizado de la ecografía escrotal en la evaluación de la infertilidad masculina a veces conduce al diagnóstico de una masa testicular incidental no palpable.
TAC de alta resolución
Generalmente se realiza una TAC de alta resolución abdominopélvica y se toma una radiografía de tórax. Se recomienda la TAC de tórax si la radiografía es anormal o si se sospecha fuertemente de enfermedad metastásica con afectación torácica. Las metástasis regionales aparecen primero en los ganglios linfáticos retroperitoneales. Aunque la TAC es la modalidad de imagen de elección para evaluar el retroperitoneo, se han descrito tasas de falsos negativos de hasta el 44%.
Las micrometástasis ocultas son responsables de la mayoría de estos falsos negativos; como lo demuestra una tasa de recaída retroperitoneal del 20 al 25% en hombres con enfermedad en estadio clínico I, que no se someten a la linfadenectomía retroperitoneal. El PET scan se usa más comúnmente para la evaluación de las masas residuales posterior al tratamiento que para la evaluación diagnóstica inicial.
Marcadores Tumorales en el Cáncer Testicular
En un hombre con probable cáncer testicular se debe solicitar biometría hemática, química sanguínea y marcadores tumorales séricos. De estos últimos, los relevantes son la alfa-fetoproteína (AFP), la subunidad β de la gonadotropina coriónica humana (β-hCG; ya que la subunidad alfa es común a varias hormonas hipofisarias) y la lactato deshidrogenasa (LDH). Los niveles séricos de AFP y/o β-hCG se elevan en el 80 a 85% de los hombres con tumores de células germinales no seminomatosos, incluso sin metástasis. En contraste, la β-hCG sérica está elevada en menos del 20% de los seminomas testiculares, y la AFP no está elevada en los seminomas puros.
Ni la β-hCG ni la AFP, solas o en combinación, son lo suficientemente sensibles o específicas para establecer el diagnóstico de cáncer testicular en ausencia de confirmación histológica. Las elevaciones importantes en estos marcadores rara vez se encuentran en hombres, excepto en los tumores de células germinales. Las concentraciones séricas de la β-hCG > 10,000 mUI/ml en hombres ocurren solo en este tipo de tumores y en los casos raros con diferenciación trofoblástica de un cáncer primario de pulmón o gástrico. Las concentraciones séricas de AFP > 10,000 ng/mL ocurren casi exclusivamente en los tumores de células germinales y en el carcinoma hepatocelular.
Estas observaciones son especialmente pertinentes para el paciente con sospecha de un tumor de células germinales extragonadal. Se pueden utilizar los marcadores tumorales séricos elevados para hacer el diagnóstico, si una biopsia no es factible o compromete a un paciente con características clínicas compatibles, o si la biopsia revela un carcinoma poco diferenciado. Aunque los marcadores tumorales séricos son útiles en el momento del diagnóstico inicial y pronóstico del cáncer testicular, su utilidad principal es para el seguimiento de la enfermedad después del tratamiento primario.
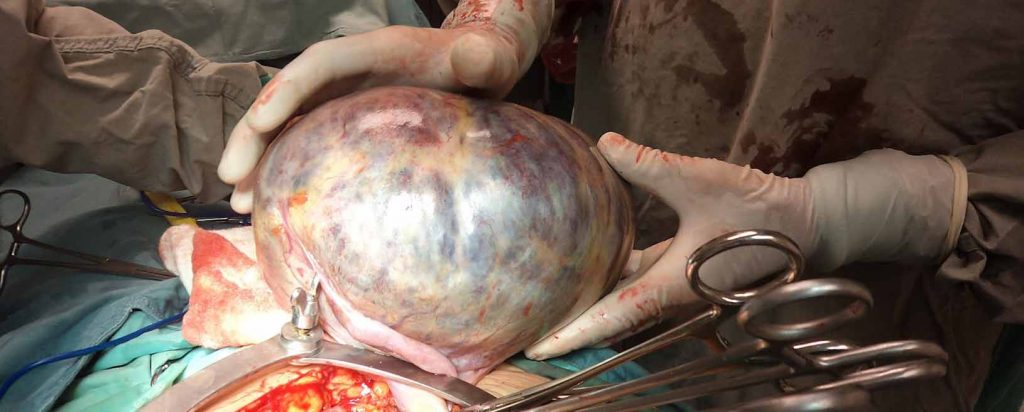
Orquiectomía Inguinal Radical en el Cáncer Testicular
Se debe realizar una orquiectomía inguinal radical para permitir la evaluación histológica del tumor primario y para proporcionar un control local del tumor. Ni la ecografía escrotal, como se mencionó anteriormente, ni los marcadores tumorales séricos, son lo suficientemente específicos para reemplazar la orquiectomía inguinal radical.
Linfadenectomía Retroperitoneal
Se trata del único método confiable para identificar micrometástasis ganglionares, dada la alta tasa de falsos negativos con la TAC. También es el estándar de oro para la estadificación patológica precisa del retroperitoneo. Tanto el número como el tamaño de los ganglios linfáticos retroperitoneales afectados tienen importancia pronóstica. Tras la evaluación radiográfica del retroperitoneo y la orquiectomía inguinal radical, un subconjunto de pacientes con tumores de células germinales no seminomatosos en estadio precoz (T1-3, N0-2, M0), es candidato a estadificación quirúrgica mediante linfadenectomía retroperitoneal.
En comparación, la quimioterapia primaria es el tratamiento de elección para los pacientes con enfermedad en estadio III o estadio II de gran volumen. En tales pacientes, la linfadenectomía retroperitoneal se reserva para aquellos con enfermedad residual posterior a la quimioterapia. La vigilancia es una opción adecuada para los hombres con cáncer testicular en estadio clínico I, especialmente aquellos con factores de riesgo limitados, como un componente mínimo de células embrionarias y la ausencia de invasión linfovascular.
Estadificación del Cáncer Testicular
Estadificación Clínica
- cTX: tumor primario no puede ser evaluado.
- cT0: No hay evidencia de tumor primario.
- cTis: Tumor de células germinales in situ.
- cT4: El tumor invade el escroto con o sin invasión linfovascular.
Estadificación Patológica
- pTX: no se puede evaluar el tumor primario.
- pT0: no hay evidencia de tumor primario.
- pTis: tumor de células germinales in situ.
- pT1: tumor limitado a los testículos (incluida la invasión del rete testis) sin invasión linfovascular.
- pT1a: tumor < 3 cm de tamaño.
- pT1b: tumor ≥ 3 cm.
- pT2: tumor limitado a los testículos (incluida la invasión del rete testis) con invasión linfovascular o tumor que invade los tejidos blandos hiliares o epidídimo o capa mesotelial visceral penetrante que cubre la superficie externa de la túnica albugínea con o sin invasión linfovascular.
- pT3: el tumor invade directamente el tejido conectivo del cordón espermático con o sin invasión linfovascular.
- pT4: el tumor invade el escroto con o sin invasión linfovascular.
Ganglios Linfáticos Regionales
- cNX: no se pueden evaluar los ganglios linfáticos regionales.
- cN0: no hay metástasis en los ganglios linfáticos regionales.
- cN1: Metástasis con una masa ganglionar de 2 cm o más pequeña en su dimensión mayor o Múltiples ganglios linfáticos, ninguno mayor de 2 cm en su dimensión mayor.
- cN2: Metástasis con una masa de ganglios linfáticos mayor de 2 cm pero no mayor de 5 cm en su dimensión mayor o Múltiples ganglios linfáticos, cualquier masa mayor de 2 cm pero no mayor de 5 cm en su mayor dimensión.
- cN3: metástasis con una masa ganglionar mayor a 5 cm en su dimensión mayor.
Metástasis a Distancia
- M0: No hay metástasis a distancia.
- M1: metástasis a distancia.
- M1a: metástasis a ganglios linfáticos o pulmonares no retroperitoneales.
- M1b: metástasis viscerales no pulmonares.
Marcadores Séricos
- SX: estudios de marcadores no disponibles o no realizados.
- S0: niveles de marcadores dentro de los límites normales.
- S1: LDH <1.5 × NΔ y hCG (mIU / mL) <5000 y AFP (ng / mL) <1000.
- S2: LDH 1.5 a 10 × NΔ o hCG (mIU / mL) 5000 a 50,000 o AFP (ng / mL) 1000 a 10,000.
- S3: LDH> 10 × NΔ o hCG (mIU / mL)> 50,000 o AFP (ng / mL)> 10,000.
Estadios del Cáncer Testicular
- Estadio 0: Tis, N0, M0, S0
- Estadio I: pT1-4, N0, M0, SX
- Estadio II: Cualquier pT/cT, N1-2, M0, SX
- Estadio III: Cualquier pT/cT, Cualquier N, M1, SX
Tratamiento del Cáncer Testicular
Seminoma en estadio temprano
Para los pacientes con un seminoma en estadio I, se puede lograr una tasa de curación extremadamente alta con la orquiectomía radical. Por lo general, a esto le sigue la vigilancia activa, pero la quimioterapia con carboplatino de agente único o la radioterapia de los ganglios paraaórticos pueden estar indicados si la vigilancia activa no es apropiada. Los hombres con seminoma en estadio II generalmente se tratan con radioterapia o quimioterapia de combinación basada en cisplatino, dependiendo de la extensión de la enfermedad retroperitoneal.
Tumores no seminomatosos en estadio temprano
En tumores no seminomatosos en estadio IA y IB, el tratamiento se basa en la presencia o ausencia de factores de riesgo específicos de recurrencia: invasión linfovascular, carcinoma embrionario que comprende > 40% del volumen total del tumor, la presencia de elementos del saco vitelino, o marcadores tumorales séricos elevados posterior a la orquiectomía que no disminuyen con la vida media esperada. En hombres que no tienen ningún factor de riesgo se recomienda vigilancia activa. Por el contrario, en hombres con factores de riesgo, se recomienda la linfadenectomía retroperitoneal.
Sin embargo, dos ciclos de un régimen a base de cisplatino son una alternativa razonable a la cirugía y con frecuencia son el tratamiento de elección en Europa. Los pacientes con marcadores tumorales persistentemente elevados después de una orquiectomía pero sin otra evidencia de enfermedad (estadio IS) deben tratarse con quimioterapia similar a aquellos con enfermedad en estadio III de bajo riesgo. En el estadio II, el tratamiento depende de la extensión de la enfermedad y de si la afectación de los ganglios linfáticos retroperitoneales está documentada patológicamente o se basa en estudios de imagen.
Las opciones de tratamiento incluyen la linfadenectomía retroperitoneal, vigilancia o el uso de quimioterapia de combinación basada en cisplatino. En los casos en estadio II patológico después de de la linfadenectomía retroperitoneal, el tratamiento se basa en el grado de afectación ganglionar. En hombres con metástasis a ganglios linfáticos de ≤2 cm en su diámetro mayor, se recomienda vigilancia. Ante compromiso ganglionar > 2 cm, se sugiere quimioterapia de combinación adyuvante. Se utilizan dos ciclos de quimioterapia basada en cisplatino.
Cáncer Testicular Avanzado
Los hombres con enfermedad avanzada se clasifican en grupos de riesgo bajo, intermedio y alto utilizando el sistema de estratificación de riesgo del Grupo Colaborativo Internacional de Cáncer de Células Germinales (IGCCCG). El sistema IGCCCG toma en cuenta el sitio del tumor primario, la enfermedad metastásica y los niveles séricos de marcadores tumorales. En pacientes con enfermedad de bajo riesgo, se recomienda la quimioterapia de combinación basada en cisplatino. El tratamiento estándar consiste en tres ciclos de bleomicina, etopósido y cisplatino (BEP).
Sin embargo, los hombres con función pulmonar deteriorada o aquellos con riesgo de lesión pulmonar inducida por bleomicina deben tratarse con etopósido y cisplatino (EP). En hombres con enfermedad de riesgo intermedio o alto, se recomiendan cuatro ciclos de BEP. Un régimen alternativo consiste en etopósido, ifosfamida y cisplatino (VIP) y se prefiere en pacientes con riesgo de lesión pulmonar inducida por bleomicina.
Referencias Bibliográficas
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019. CA Cancer J Clin 2019; 69:7.
Bray F, Richiardi L, Ekbom A, et al. Trends in testicular cancer incidence and mortality in 22 European countries: continuing increases in incidence and declines in mortality. Int J Cancer 2006; 118:3099.
McGlynn KA, Devesa SS, Sigurdson AJ, et al. Trends in the incidence of testicular germ cell tumors in the United States. Cancer 2003; 97:63.
Nigam M, Aschebrook-Kilfoy B, Shikanov S, Eggener S. Increasing incidence of testicular cancer in the United States and Europe between 1992 and 2009. World J Urol 2015; 33:623.
Zequi Sde C, da Costa WH, Santana TB, et al. Bilateral testicular germ cell tumours: a systematic review. BJU Int 2012; 110:1102.
Kier MG, Lauritsen J, Almstrup K, et al. Screening for carcinoma in situ in the contralateral testicle in patients with testicular cancer: a population-based study. Ann Oncol 2015; 26:737.
Voltz R, Gultekin SH, Rosenfeld MR, et al. A serologic marker of paraneoplastic limbic and brain-stem encephalitis in patients with testicular cancer. N Engl J Med 1999; 340:1788.
Benson CB. The role of ultrasound in diagnosis and staging of testicular cancer. Semin Urol 1988; 6:189.
Marth D, Scheidegger J, Studer UE. Ultrasonography of testicular tumors. Urol Int 1990; 45:237.
Schultz-Lampel D, Bogaert G, Thüroff JW, et al. MRI for evaluation of scrotal pathology. Urol Res 1991; 19:289.
Toren PJ, Roberts M, Lecker I, et al. Small incidentally discovered testicular masses in infertile men–is active surveillance the new standard of care? J Urol 2010; 183:1373.
Eifler JB Jr, King P, Schlegel PN. Incidental testicular lesions found during infertility evaluation are usually benign and may be managed conservatively. J Urol 2008; 180:261.
Bower M, Rustin GJ. Serum tumor markers and their role in monitoring germ cell cancers of the testis. In: Textbook of Genitourinary Oncology, 2nd, Vogelzang NJ, Scardino PT, Shipley,WU, Coffey, DS (Eds), Lippincott, Williams and Wilkins, Philadelphia 2000. p.931.
Moch, H., Humphrey, et al. WHO Classification of Tumours of the Urinary System and Male Genital Organs, 4.
Karpathakis A, Jamal-Hanjani M, Kwan A, et al. Testicular germ cell tumors with bony metastases: Diagnosis, management, and outcomes (a case series). J Clin Oncol 30, 2012 (suppl 5; abstr 343).
Fosså SD, Kravdal O. Fertility in Norwegian testicular cancer patients. Br J Cancer 2000; 82:737.