Estridor Laríngeo Congénito o Laringomalacia y Traqueomalacia.

Las malformaciones congénitas son el producto de alteraciones durante la embriogénesis o el resultado de eventos intrauterinos que afectan el crecimiento embrionario y fetal. Cuanto más compleja es la formación de una estructura, mayor la probabilidad de malformación. Los defectos en la formación y el crecimiento de la laringe conducen a una variedad de malformaciones; sin embargo, revisaremos únicamente las más importantes, el estridor laríngeo congénito o laringomalacia y la traqueomalacia.
Laringomalacia
La laringomalacia se refiere al colapso de las estructuras supraglóticas durante la inspiración. Es la anomalía congénita más común de la laringe y también se denomina estridor laríngeo congénito. Es distinto de la traqueomalacia, que tiene una presentación clínica diferente y se aborda más adelante en esta revisión.
La etiología de la laringomalacia no está claramente definida, y pueden aplicar diferentes mecanismos en diferentes casos. Los mecanismos propuestos incluyen la maduración tardía o “hipotonía” de las estructuras cartilaginosas de soporte de la laringe, tejido blando redundante en la supraglotis, un pliegue ariepiglótico acortado, trastornos neuromusculares subyacentes y edema supraglótico (posiblemente relacionado con reflujo gastroesofágico).
En estudios histológicos, los tejidos supraglóticos extirpados quirúrgicamente de bebés con laringomalacia no son distintos de aquellos de infantes sin laringomalacia, lo que debilita la teoría del cartílago blando o “malacia”. La frecuente concurrencia de reflujo gastroesofágico, la variación en la gravedad con el estado de conciencia y el nuevo inicio de laringomalacia después de lesiones neurológicas respaldan la hipótesis de que se trata de un trastorno neuromuscular.
Presentación Clínica de la Laringomalacia
La laringomalacia se manifiesta con estridor inspiratorio “húmedo” de tono bajo intermitente, generalmente en el período neonatal. En la mayoría de los casos, el estridor es más fuerte entre los cuatro y los ocho meses de edad y se resuelve entre los 12 y los 18 meses. El estridor es más intenso durante las infecciones del tracto respiratorio superior. A menudo, el estridor empeora en la posición supina y puede mejorar cuando el lactante está en prono.
En los bebés con laringomalacia leve a moderada, el estridor suele ser más intenso cuando el lactante se alimenta o duerme y puede desaparecer completamente cuando llora (aunque esto puede ser difícil de detectar debido al llanto). En los pacientes con laringomalacia grave, por el contrario, el estridor empeora durante el llanto. En algunos bebés, el estridor puede estar presente solo durante el sueño o la relajación. Otras características de presentación incluyen:
- Ronquido y/o alteración de la respiración durante el sueño (25%).
- Disfunción de la deglución y/o dificultad para alimentarse (10 al 50%).
- Reflujo gastroesofágico y reflujo laringofaríngeo o síndrome de Cherry (reflujo más allá del esófago hacia la laringe, orofaringe o nasofaringe; 60 a 70%).
Los niños con formas leves de laringomalacia respiran y se alimentan bien a pesar de su respiración ruidosa. Las formas más graves dan lugar a retracciones supraesternales o subesternales, mala alimentación, alteración de la respiración durante el sueño y deterioro del crecimiento. Hasta el 20% de los bebés con laringomalacia tienen otras malformaciones en las vías respiratorias (p.e. traqueomalacia), pero aquellas que amenazan la vida son poco frecuentes. La laringomalacia puede ser una entidad aislada u ocurrir en asociación con síndromes congénitos; por ejemplo, síndrome de Down, síndrome de DiGeorge (deleción 22q11)) u otras anomalías no respiratorias.
Diagnóstico de Laringomalacia
El diagnóstico de presunción de laringomalacia generalmente se hace mediante la historia clínica y el examen físico. Se confirma mediante laringoscopia de fibra óptica flexible. El pediatra con experiencia no necesita referir a todos los niños con estridor inspiratorio leve al otorrinolaringólogo pediatra. Los niños con estridor importante o progresivo, apnea, episodios cianóticos o bajo crecimiento requieren confirmación endoscópica. Muchas otras malformaciones de las vías respiratorias potencialmente peligrosas pueden tener presentaciones clínicas similares. La disfonía no es característica de la laringomalacia.
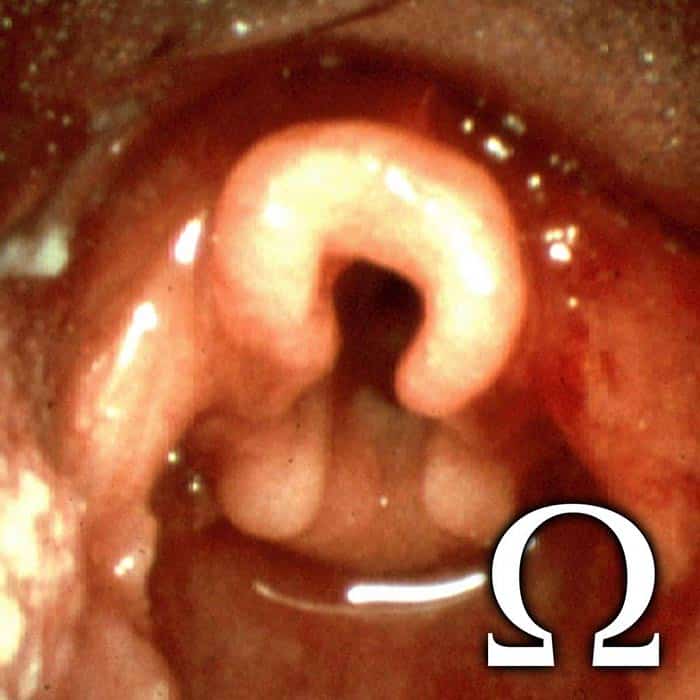
Otras causas del estridor incluyen estenosis subglótica, parálisis de las cuerdas vocales, anillo vascular, masa laríngea (por ejemplo, quiste o hemangioma), hemangioma subglótico y traqueomalacia.
Gravedad
La gravedad de la laringomalacia está determinada por el grado y las secuelas de la obstrucción de las vías respiratorias y la respuesta a las intervenciones conservadoras (por ejemplo, cambio de posición, modificaciones en la alimentación, tratamiento para el reflujo gastroesofágico).
Anomalías asociadas
La necesidad de una evaluación complementaria (p.e. laringoscopia directa o broncoscopia de fibra óptica flexible) para malformaciones laringotraqueales concurrentes (p.e. atresia esofágica o traqueoesofágica) es controvertida. Existe un consenso de que la evaluación complementaria es necesaria en los bebés con cianosis, apnea, disfonía, dificultad para alimentarse, retraso en el desarrollo o estridor atípico.
Endoscopia durante el sueño
La endoscopia durante el sueño ha demostrado ser útil en el diagnóstico de laringomalacia sueño dependiente. Algunos bebés muestran signos de colapso supraglótico solo durante el sueño natural o durante la relajación inducida por fármacos con respiración espontánea. La endoscopia durante el sueño puede identificar esta variante y ayudar a definir las áreas del prolapso supraglótico.
Manejo de la Laringomalacia
El manejo de la laringomalacia depende de la gravedad. En la gran mayoría de los niños sin otra malformación, la laringomalacia no es peligrosa y se resuelve espontáneamente. Los bebés con laringomalacia leve (estridor leve intermitente sin otros síntomas) pueden ser monitoreados clínicamente para asegurarse de que el aumento de peso sea el adecuado. Los bebés que se sabe que tienen reflujo gastroesofágico asociado deben recibir tratamiento para el reflujo. No existe una buena base científica para guiar la decisión entre una evaluación diagnóstica completa y tratamiento empírico para el reflujo gastroesofágico en el niño con laringomalacia.
El tratamiento médico del reflujo, incluida la supresión ácida, la terapia de deglución y/o la fórmula alta en calorías, es un tratamiento adecuado en algunos bebés con enfermedad leve a moderada. Los bebés con laringomalacia moderada a grave (estridor con dificultad para alimentarse, disnea, taquipnea, cianosis, apnea) deben remitirse a un otorrinolaringólogo para una evaluación endoscópica completa y una posible intervención. Los niños con laringomalacia grave a menudo se benefician de la cirugía para extirpar el tejido supraglótico redundante. En manos experimentadas, esta cirugía puede producir mejoras dramáticas en la respiración, la alimentación y el crecimiento con poca morbilidad.
Los padres reportan una mejor calidad de vida para los niños que se someten a supraglotoplastia. Dos metaanálisis encontraron que para los niños con apnea obstructiva del sueño debido a laringomalacia, la supraglotoplastia se asocia a una mejoría en el índice de apnea-hipopnea y saturación de oxígeno; sin embargo, la mayoría tienen enfermedad residual después del procedimiento. Las posibles complicaciones incluyen cicatrización supraglótica o glótica y posterior aspiración crónica o disfonía, por lo que no se debe realizar cirugía ante indicaciones mínimas (para p.e. aliviar la preocupación de los padres con respecto a una respiración ruidosa).
Traqueomalacia
La traqueomalacia es una anomalía relativamente común del tracto respiratorio superior caracterizada por un colapso dinámico de la tráquea durante la respiración, lo que resulta en obstrucción de las vías respiratorias. Debido a que la mayoría de las lesiones son intratorácicas, el colapso de las vías respiratorias generalmente ocurre durante la espiración. Las lesiones extratorácicas en la tráquea cervical son raras y conducen a un colapso durante la inspiración. La traqueomalacia a menudo se clasifica como congénita (primaria) o adquirida (secundaria). Existen múltiples causas para ambos casos.
Los trastornos congénitos que se asocian con la traqueomalacia incluyen cualquier entidad que conduzca a la compresión traqueal intrauterina (p.e. cardiopatía congénita con cardiomegalia o masas intratorácicas), anomalías craneofaciales y otros síndromes genéticos, mucopolisacaridosis, enfermedades del tejido conectivo y otras. Las causas adquiridas incluyen aquellas relacionadas con barotrauma crónico (por ventilación con presión positiva), infección o inflamación.
Traqueobroncomalacia es el término más general para el colapso dinámico de vías aéreas grandes o pequeñas. La clasificación de este trastorno se basa en los hallazgos clínicos, endoscópicos e histopatológicos. Se describen tres tipos de lesiones, de la siguiente manera:
- El tipo 1 es causado por un defecto intrínseco en la porción cartilaginosa de la tráquea que conduce a un aumento de la proporción de la tráquea membranosa. La falta de soporte cartilaginoso provoca el colapso de la vía aérea.
- El tipo 2 es causado por la compresión traqueal extrínseca por estructuras cardiovasculares, tumores, ganglios linfáticos u otras masas. Este tipo puede ser congénito o adquirido.
- Las lesiones de tipo 3 resultan de una ventilación con presión positiva prolongada o de un proceso infeccioso o inflamatorio que socava el soporte cartilaginoso intrínseco de la tráquea.
La traqueomalacia es una complicación frecuente de la reparación quirúrgica de la atresia esofágica y la fístula traqueoesofágica.
Presentación Clínica de la Traqueomalacia
Los signos y síntomas dependen de la ubicación y la gravedad de la lesión traqueal. Las lesiones intratorácicas se presentan típicamente con una tos áspera, de ladrido o similar a un crup recurrente, mientras que las lesiones extratorácicas causan estridor inspiratorio; ambos pueden causar dificultad respiratoria. Una mayor extensión del colapso se asocia a una presentación más temprana.
Los bebés y niños pequeños con traqueobroncomalacia son propensos a enfermedades respiratorias más frecuentes y retraso en su recuperación, pero el sitio y la gravedad de la traqueomalacia no predicen el tipo de enfermedad respiratoria adquirida. Además, existe una asociación entre la traqueomalacia y la bronquitis bacteriana prolongada. El mecanismo de esta asociación no ha sido esclarecido.
Diagnóstico de Traqueomalacia
La evaluación de un niño con posible traqueomalacia se realiza generalmente si existe un alto índice de sospecha basado en la historia clínica y el examen físico. La endoscopia dinámica de la vía aérea es la herramienta diagnóstica de elección. Las radiografías de tórax tienen poca utilidad para hacer un diagnóstico de traqueomalacia porque la mayoría de los pacientes afectados tienen radiografías de tórax normales cuando inspiran y retienen la respiración.
El diagnóstico definitivo suele hacerse por broncoscopia durante la respiración espontánea. Con esta técnica, se observa que la tráquea se colapsa durante la espiración. El diagnóstico no invasivo de este trastorno puede mejorarse mediante técnicas de imagen más nuevas, incluida la tomografía computarizada multidetector en la que se obtienen imágenes de espiración final y de inspiración final. Los niños mayores de cinco años generalmente pueden realizar voluntariamente las maniobras de respiración necesarias para esta técnica; los más pequeños y los bebés generalmente requieren intubación endotraqueal. También se ha recomendado un enfoque combinado que utilice endoscopia y tomografía computarizada tridimensional.
La tomografía computarizada estándar o la resonancia magnética no son adecuadas para el diagnóstico de traqueobroncomalacia porque las imágenes generalmente se obtienen durante la inspiración final y la malacia puede no ser evidente. Sin embargo, en algunos casos, estos estudios de imagen pueden ser útiles para definir la extensión de la lesión. La nueva tecnología de TAC y RM dinámica es prometedora como alternativa diagnóstica. La angio-resonancia magnética se puede usar para diagnosticar anomalías vasculares, que pueden causar compresión traqueobronquial extrínseca y algunas veces se asocian a traqueomalacia.
Manejo de la Traqueomalacia
El pronóstico a largo plazo de este trastorno es bueno en niños sin comorbilidad. La mayoría de los bebés afectados mejoran espontáneamente entre los 6 y 12 meses de edad a medida que aumenta el calibre de las vías respiratorias y se desarrolla cartílago. Sin embargo, algunos permanecen sintomáticos o tienen intolerancia al ejercicio de adultos. Puede ser necesaria la intervención en niños con episodios de obstrucción de las vías respiratorias que ponen en peligro la vida, infecciones recurrentes, insuficiencia respiratoria o retraso en el desarrollo.
El tratamiento más utilizado es la presión positiva continua de la vía respiratoria (no invasiva o invasiva a través de la traqueotomía), aunque también se ha sugerido la farmacoterapia. También se han informado abordajes quirúrgicos como la reconstrucción traqueal, la colocación de un stent traqueal y la suspensión quirúrgica de la tráquea (traqueopexia). Los stents endoluminales generalmente se evitan debido a muchas complicaciones con el uso a largo plazo, aunque a veces se usan para el manejo a corto plazo. Los stents metálicos expansivos, en particular, se han asociado con una alta incidencia de complicaciones y se utilizan sólo en situaciones que ponen en peligro la vida.
Los stents externos personalizados impresos en 3D, o placas bioabsorbibles externas, son una nueva tecnología para la colocación de stents de la vía respiratoria, con resultados prometedores. La aortopexia, la suspensión quirúrgica de la aorta al esternón, se ha descrito como un tratamiento eficaz para la traqueomalacia grave secundaria a múltiples etiologías. Además de disminuir la compresión de la tráquea causada por algunas malformaciones vasculares, la aortopexia empuja la pared traqueal anterior hacia el esternón, mejorando la permeabilidad de las vías respiratorias.
Referencias Bibliográficas
Olney DR, Greinwald JH Jr, Smith RJ, Bauman NM. Laryngomalacia and its treatment. Laryngoscope 1999; 109:1770.
Shah UK, Wetmore RF. Laryngomalacia: a proposed classification form. Int J Pediatr Otorhinolaryngol 1998; 46:21.
Richter GT, Thompson DM. The surgical management of laryngomalacia. Otolaryngol Clin North Am 2008; 41:837.
Kay DJ, Goldsmith AJ. Laryngomalacia: a classification system and surgical treatment strategy. Ear Nose Throat J 2006; 85:328.
Thompson DM. Abnormal sensorimotor integrative function of the larynx in congenital laryngomalacia: a new theory of etiology. Laryngoscope 2007; 117:1.
Carter J, Rahbar R, Brigger M, et al. International Pediatric ORL Group (IPOG) laryngomalacia consensus recommendations. Int J Pediatr Otorhinolaryngol 2016; 86:256.
Smith JL 2nd, Sweeney DM, Smallman B, Mortelliti A. State-dependent laryngomalacia in sleeping children. Ann Otol Rhinol Laryngol 2005; 114:111.
Amin MR, Isaacson G. State-dependent laryngomalacia. Ann Otol Rhinol Laryngol 1997; 106:887.
Giannoni C, Sulek M, Friedman EM, Duncan NO 3rd. Gastroesophageal reflux association with laryngomalacia: a prospective study. Int J Pediatr Otorhinolaryngol 1998; 43:11.
Simons JP, Greenberg LL, Mehta DK, et al. Laryngomalacia and swallowing function in children. Laryngoscope 2016; 126:478.
Cooper T, Benoit M, Erickson B, El-Hakim H. Primary Presentations of Laryngomalacia. JAMA Otolaryngol Head Neck Surg 2014; 140:521.
Mancuso RF, Choi SS, Zalzal GH, Grundfast KM. Laryngomalacia. The search for the second lesion. Arch Otolaryngol Head Neck Surg 1996; 122:302.
Bluestone CD, Healy GB, Cotton RT. Diagnosis of laryngomalacia is not enough! Arch Otolaryngol Head Neck Surg 1996; 122:1417.
Mase CA, Chen ML, Horn DL, Parikh SR. Supraglottoplasty for sleep endoscopy diagnosed sleep dependent laryngomalacia. Int J Pediatr Otorhinolaryngol 2015; 79:511.
Gilger MA. Pediatric otolaryngologic manifestations of gastroesophageal reflux disease. Curr Gastroenterol Rep 2003; 5:247.
Stavroulaki P. Diagnostic and management problems of laryngopharyngeal reflux disease in children. Int J Pediatr Otorhinolaryngol 2006; 70:579.
El-Serag HB, Gilger M, Kuebeler M, Rabeneck L. Extraesophageal associations of gastroesophageal reflux disease in children without neurologic defects. Gastroenterology 2001; 121:1294.
Apps JR, Flint JD, Wacogne I. Towards evidence based medicine for paediatricians. Question 1. Does anti-reflux therapy improve symptoms in infants with laryngomalacia? Arch Dis Child 2012; 97:385.
Faria J, Behar P. Medical and surgical management of congenital laryngomalacia: a case-control study. Otolaryngol Head Neck Surg 2014; 151:845.
Friedman EM, Vastola AP, McGill TJ, Healy GB. Chronic pediatric stridor: etiology and outcome. Laryngoscope 1990; 100:277.
Meier JD, Nguyen SA, White DR. Improved growth curve measurements after supraglottoplasty. Laryngoscope 2011; 121:1574.
Garritano FG, Carr MM. Characteristics of patients undergoing supraglottoplasty for laryngomalacia. Int J Pediatr Otorhinolaryngol 2014; 78:1095.
Burden RJ, Shann F, Butt W, Ditchfield M. Tracheobronchial malacia and stenosis in children in intensive care: bronchograms help to predict oucome. Thorax 1999; 54:511.
Inwald DP, Roebuck D, Elliott MJ, Mok Q. Current management and outcome of tracheobronchial malacia and stenosis presenting to the paediatric intensive care unit. Intensive Care Med 2001; 27:722.
Carden KA, Boiselle PM, Waltz DA, Ernst A. Tracheomalacia and tracheobronchomalacia in children and adults: an in-depth review. Chest 2005; 127:984.
Austin J, Ali T. Tracheomalacia and bronchomalacia in children: pathophysiology, assessment, treatment and anaesthesia management. Paediatr Anaesth 2003; 13:3.
McNamara VM, Crabbe DC. Tracheomalacia. Paediatr Respir Rev 2004; 5:147.
Wright CD. Tracheomalacia. Chest Surg Clin N Am 2003; 13:349.
Pillai JB, Smith J, Hasan A, Spencer D. Review of pediatric airway malacia and its management, with emphasis on stenting. Eur J Cardiothorac Surg 2005; 27:35.
Hysinger EB, Panitch HB. Paediatric Tracheomalacia. Paediatr Respir Rev 2016; 17:9.
Mair EA, Parsons DS. Pediatric tracheobronchomalacia and major airway collapse. Ann Otol Rhinol Laryngol 1992; 101:300.
Sebening C, Jakob H, Tochtermann U, et al. Vascular tracheobronchial compression syndromes– experience in surgical treatment and literature review. Thorac Cardiovasc Surg 2000; 48:164.
McLaughlin RB Jr, Wetmore RF, Tavill MA, et al. Vascular anomalies causing symptomatic tracheobronchial compression. Laryngoscope 1999; 109:312.
Kazim R, Berdon WE, Montoya CH, et al. Tracheobronchial anomalies in children with congenital cardiac disease. J Cardiothorac Vasc Anesth 1998; 12:553.
McCarthy MJ, Rosado-de-Christenson ML. Tumors of the trachea. J Thorac Imaging 1995; 10:180.
Masters IB, Zimmerman PV, Pandeya N, et al. Quantified tracheobronchomalacia disorders and their clinical profiles in children. Chest 2008; 133:461.
Kompare M, Weinberger M. Protracted bacterial bronchitis in young children: association with airway malacia. J Pediatr 2012; 160:88.
Walner DL, Ouanounou S, Donnelly LF, Cotton RT. Utility of radiographs in the evaluation of pediatric upper airway obstruction. Ann Otol Rhinol Laryngol 1999; 108:378.
Lee EY, Boiselle PM. Tracheobronchomalacia in infants and children: multidetector CT evaluation. Radiology 2009; 252:7.
Hein E, Rogalla P, Hentschel C, et al. Dynamic and quantitative assessment of tracheomalacia by electron beam tomography: correlation with clinical symptoms and bronchoscopy. J Comput Assist Tomogr 2000; 24:247.
Goo HW. Free-breathing cine CT for the diagnosis of tracheomalacia in young children. Pediatr Radiol 2013; 43:922.
Ullmann N, Secinaro A, Menchini L, et al. Dynamic expiratory CT: An effective non-invasive diagnostic exam for fragile children with suspected tracheo-bronchomalacia. Pediatr Pulmonol 2018; 53:73.
Briganti V, Oriolo L, Mangia G, et al. Tracheomalacia in esophageal atresia. Usefulness of preoperative imaging evaluation for tailored surgical correction. J Pediatr Surg 2006; 41:1624.
Briganti V, Oriolo L, Buffa V, et al. Tracheomalacia in oesophageal atresia: morphological considerations by endoscopic and CT study. Eur J Cardiothorac Surg 2005; 28:11.
Malik TH, Bruce IA, Kaushik V, et al. The role of magnetic resonance imaging in the assessment of suspected extrinsic tracheobronchial compression due to vascular anomalies. Arch Dis Child 2006; 91:52.
Morabito A, MacKinnon E, Alizai N, et al. The anterior mediastinal approach for management of tracheomalacia. J Pediatr Surg 2000; 35:1456.
Casiano RR, Numa WA, Nurko YJ. Efficacy of transoral intraluminal Wallstents for tracheal stenosis or tracheomalacia. Laryngoscope 2000; 110:1607.
Furman RH, Backer CL, Dunham ME, et al. The use of balloon-expandable metallic stents in the treatment of pediatric tracheomalacia and bronchomalacia. Arch Otolaryngol Head Neck Surg 1999; 125:203.
Tsugawa C, Nishijima E, Muraji T, et al. A shape memory airway stent for tracheobronchomalacia in children: an experimental and clinical study. J Pediatr Surg 1997; 32:50.





