Micosis: Revisión de las más Importantes en la Práctica Clínica.

Revisamos en esta ocasión las micosis más importantes en la práctica clínica, haciendo énfasis en los factores de riesgo, presentación clínica y tratamiento. Comenzaremos por las micosis cutáneas y superficiales, seguido de las subcutáneas, las sistémicas y por último las micosis oportunistas.
Los hongos son células eucariotas con metabolismo quimioheterótrofo. Su pared celular está compuesta de quitina, celulosa o ambos y su unidad estructural es el “talo”. Las levaduras son hongos que se reproducen por gemación, con la formación de blastoconidias. A la formación lineal de blastoconidias se le conoce como pseudohifas, con algunas levaduras capaces de formar hifas verdaderas. En los medios de cultivo dan forma a colonias redondas de consistencia pastosa o mucosa.
Los hongos filamentosos son estructuras multicelulares y constituidos por hifas, que al entrelazarse dan forma a los micelios. Las colonias en los medios de cultivo tienen apariencia aterciopelada o con formación de micelios aéreos, de aspecto peludo. Existen múltiples hongos que pueden adoptar ambas formas, por lo que se les determina dimórficos. Por otro lado, los hongos se reproducen por esporas, las cuales pueden ser asexuadas (mitosis) o sexuadas (meiosis); siendo ambas formas de reproducción posibles en un mismo hongo. Las esporas asexuadas pueden ser esporangiosporas o conifias, siendo éstas últimas típicas de los deuteromicetos u hongos imperfectos.
Antifúngicos
| Fármaco | Mecanismo de Acción | Características |
|---|---|---|
| Griseofulvina y terbinafina | Griseofulbina: Inhibe síntesis de ARN o ADN. Terbinafina: Inhibe síntesis de ergosterol y altera la permeabilidad de la membrana. | Útiles únicamente en las dermatomicosis. |
| Nistatina | Altera la permeabilidad de la membrana. | Únicamente tópica en candidiasis superficiales (cutáneas o mucosas). |
| Anfotericina B | Altera la permeabilidad de la membrana. | Fungicida y el más eficaz de los antifúngicos. De elección en las micosis graves. Se administra IV. Toxicidad: hipopotasemia, hipomagnesemia y nefrotoxicidad dosis-dependiente. |
| Azoles | Inhiben la síntesis de ergosterol. | La mayoría son tópicos, para micosis cutáneas o mucosas (clotrimazol). |
| Equinocandinas | Inhiben la síntesis de la pared fúngica. | Caspofungina, micafungina. Tx. de aspergilosis refractaria en pacientes neutropénicos y candidiasis invasoras por cepas resistentes a azoles. |
| 5-flucitosina | Inhibe síntesis de ARN o ADN. | De uso exlusivo en asociación a Anfotericina B en el Tx. de algunas candidiasis profundas o en la meningitis criptocócica. |
Tiña Versicolor
La tiña versicolor (pitiriasis versicolor) es una infección micótica superficial común. Los pacientes con este trastorno a menudo se presentan con máculas hipopigmentadas, hiperpigmentadas o eritematosas en el tronco y las extremidades superiores proximales. A diferencia de otros trastornos que utilizan el término tiña (p.e. tiña pedis, tiña capitis), la tiña versicolor no es una infección por dermatofitos (ver más abajo). Los organismos causantes son levaduras saprófitas dependientes de lípidos del género Malassezia (anteriormente conocido como Pityrosporum).
La tiña versicolor afecta con mayor frecuencia a adolescentes y adultos jóvenes, pero también puede ocurrir en niños y se ha reportado en bebés. El trastorno no es contagioso. Malassezia es un hongo dimorfo dependiente de lípidos y un componente de la flora cutánea normal. La transformación de Malassezia de levadura a una forma micelial patógena se asocia con el desarrollo de enfermedad clínica. Los factores externos que se sospecha contribuyen a esta conversión incluyen la exposición al clima cálido y húmedo, la hiperhidrosis y el uso de aceites tópicos para la piel. La tiña versicolor no está relacionada con una higiene deficiente.
Presentación Clínica
El término “versicolor” se refiere a los cambios variables en la pigmentación cutánea que pueden ocurrir en este trastorno. Las máculas, parches y placas delgadas de tiña versicolor pueden ser hipopigmentadas, hiperpigmentadas o levemente eritematosas. En personas de piel clara, la tiña versicolor hiperpigmentada suele ser de color marrón claro. La tinea versicolor hiperpigmentada puede presentarse como máculas y parches de color marrón oscuro a gris-negruzco en aquellos con piel oscura.
Los pacientes con tiña versicolor hipopigmentada a menudo notan que el trastorno es más prominente durante el verano, cuando las áreas afectadas no se broncean después de la exposición al sol. Los efectos inhibidores o perjudiciales sobre los melanocitos por el ácido azelaico (un ácido dicarboxílico producido por Malassezia) pueden desempeñar un papel en el desarrollo de la hipopigmentación. Las lesiones hiperpigmentadas y eritematosas pueden ser consecuencia de una reacción inflamatoria a la levadura.
En adolescentes y adultos, la tiña versicolor se encuentra con mayor frecuencia en el tronco superior y las extremidades superiores proximales, y con menor frecuencia en la cara y las áreas intertriginosas. En contraste, cuando la tiña versicolor ocurre en niños, es probable que involucre la cara.

Diagnóstico
Las características clínicas variables de la tiña versicolor y la existencia de otros trastornos cutáneos con hallazgos similares hacen que sea preferible confirmar el diagnóstico con una preparación de hidróxido de potasio (KOH). Tanto las hifas como la levadura son evidentes en un patrón que a menudo se describe como “espagueti y albóndigas”. Además, en aproximadamente un tercio de los casos, el examen con una lámpara de Wood revelará fluorescencia de amarillo a amarillo verdoso.
Tratamiento
El tratamiento tópico es el de elección para los pacientes con tiña versicolor. El tratamiento sistémico generalmente se reserva para pacientes con tiña versicolor generalizada o recurrente, o para pacientes con fracaso del tratamiento tópico. Antes del tratamiento, se debe informar a los pacientes que los cambios en la pigmentación cutánea a menudo persisten después del tratamiento exitoso. La restauración de la pigmentación normal puede tomar meses después de la finalización del tratamiento exitoso.
Los medicamentos antimicóticos tópicos son tratamientos de primera línea efectivos y bien tolerados para la tiña versicolor. Los antifúngicos azólicos tópicos y la terbinafina tópica mejoran la tiña versicolor a través de actividad antifúngica directa. El tratamiento con un antifúngico azólico tópico (p.e. ketoconazol en crema al 2%) consiste en la aplicación diaria durante dos semanas. La solución tópica de terbinafina al 1% aplicada dos veces al día durante una semana también ha demostrado ser eficaz.
Dermatomicosis
Las infecciones por dermatofitos son comunes en todo el mundo, y son la causa predominante de infección fúngica de la piel, el cabello y las uñas. Estas infecciones conducen a una variedad de manifestaciones clínicas, como la tiña pedis, tiña corporis, tiña cruris, granuloma de Majocchi, tiña capitis y tiña unguium (onicomicosis dermatofítica). Los dermatofitos son hongos filamentosos de los géneros Trichophyton, Microsporum y Epidermophyton. Los dermatofitos metabolizan y subsisten sobre la queratina en la piel, el cabello y las uñas. Los principales subtipos clínicos de las infecciones por dermatofitos son:
- Tiña corporis: Infección de superficies corporales distintas de los pies, la ingle, la cara, el cabello del cuero cabelludo o el pelo de la barba.
- Tiña pedis: Infección del pie
- Tiña crural: Infección de la ingle
- Tiña capitis: Infección del cuero cabelludo
- Tiña unguium (onicomicosis dermatofítica): Infección de la uña
Ocasionalmente, las infecciones por dermatofitos penetran el folículo piloso y la dermis causando una afección llamada granuloma de Majocchi. La tinea capitis y la tinea barbae se caracterizan por la infección de los pelos terminales.

Diagnóstico
El diagnóstico de una infección dermatofítica cutánea puede sospecharse con base en los hallazgos clínicos. Sin embargo, se recomiendan las pruebas para confirmar el diagnóstico debido a que una variedad de trastornos cutáneos pueden presentar características similares. Una preparación de hidróxido de potasio (KOH) es un método rápido para confirmar el diagnóstico.
Tratamiento
Los fármacos antimicóticos tópicos o sistémicos con actividad anti-dermatofítica son tratamientos efectivos. La mayoría de las infecciones superficiales por dermatofitos cutáneos se pueden tratar con azoles. La nistatina, un tratamiento efectivo para las infecciones superficiales por Candida, no es efectiva para los dermatofitos. El tratamiento oral con agentes como terbinafina, itraconazol, fluconazol y griseofulvina se usa para infecciones cutáneas extensas o refractarias e infecciones que se extienden a los folículos o la dermis (p.e. granuloma de Majocchi) o que involucran uñas. Los pacientes no deben ser tratados con ketoconazol oral debido al riesgo de lesión hepática grave, insuficiencia suprarrenal e interacciones medicamentosas.
Esporotricosis
La esporotricosis es una infección subaguda a crónica causada por el hongo dimorfo Sporothrix schenckii. La infección generalmente involucra tejidos cutáneos y subcutáneos, pero ocasionalmente puede ocurrir en otros sitios, principalmente en pacientes inmunocomprometidos. Las actividades asociadas con el desarrollo de la esporotricosis incluyen jardinería ornamental, jardinería de rosas y otras actividades que implican la inoculación del suelo a través de la piel.
La esporotricosis generalmente ocurre después de que el suelo, el musgo u otro material orgánico que contiene el hongo se inocula en la piel o el tejido subcutáneo. Los pacientes con infección pulmonar desarrollan infección después de la inhalación de conidios de S. schenckii; algunos casos de infección diseminada pueden ocurrir posterior a la inhalación. El paciente típico con esporotricosis linfocutánea es un individuo sano con una ocupación o afición al aire libre con riesgo de exposición al hongo. Las infecciones que involucran estructuras osteoarticulares, pulmones, meninges y otras vísceras son poco comunes y ocurren con mayor frecuencia en individuos con enfermedades subyacentes, que incluyen
Esporotricosis Linfocutánea
La esporotricosis linfocutánea es la forma más común de esporotricosis observada en la práctica clínica. Posterior a días o semanas después de la inoculación cutánea del hongo, se desarrolla una pápula en el sitio de la inoculación. Esta lesión primaria generalmente se ulcera pero puede permanecer nodular con eritema suprayacente; el drenaje de la lesión no es muy purulento y no tiene olor. Posteriormente, se producen lesiones similares a lo largo de las vías linfáticas proximales a la lesión original, un hallazgo llamado diseminación esporotricoide o linfangitis nodular. El dolor generalmente es leve y los síntomas sistémicos generalmente están ausentes. El diagnóstico diferencial para esta forma de esporotricosis incluye:
- Infección por micobacterias no tuberculosas, especialmente Mycobacterium marinum
- Infecciones por Nocardia, particularmente Nocardia brasiliensis
- Infección por Leishmania brasiliensis
- Tularemia
Sin embargo, muchas otras infecciones fúngicas, bacterianas y virales rara vez causan un síndrome linfocutáneo (también llamado linfangitis nodular). Algunos pacientes tienen una lesión cutánea crónica y fija; esta forma se ve con mayor frecuencia en regiones endémicas de América del Sur. Estas lesiones fijas, que se encuentran con frecuencia en la cara y las extremidades, tienden a ser en forma de placa o verrugosas, pero también pueden ulcerarse.
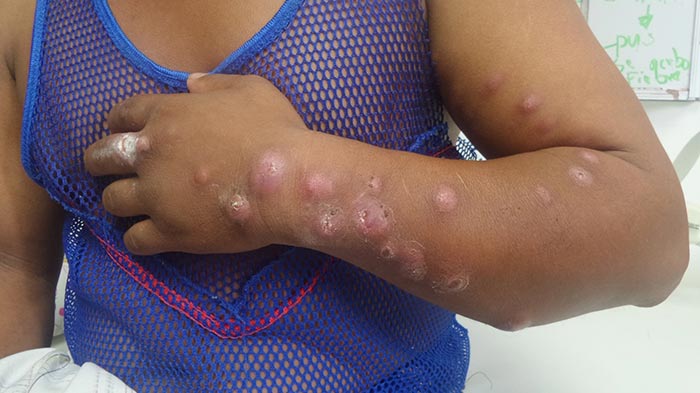
Esporotricosis Osteoarticular
Al igual que la esporotricosis pulmonar, esta manifestación poco común de esporotricosis se encuentra con mayor frecuencia en hombres de mediana edad y parece ocurrir con mayor frecuencia en alcohólicos. La enfermedad generalmente surge por diseminación hematógena, pero también puede ocurrir después de la inoculación local. La infección puede implicar una o varias articulaciones, y puede o no estar acompañada de lesiones cutáneas superpuestas. Las articulaciones afectadas más comúnmente son la rodilla, el codo, la muñeca y el tobillo.
La infección de las articulaciones es más común que la osteomielitis. Cuando el hueso está involucrado, por lo general se presenta contiguo a una articulación infectada en lugar de osteomielitis aislada. Se han informado casos de bursitis y tenosinovitis, que a veces se presentan como un síndrome de atrapamiento nervioso. La esporotricosis osteoarticular es crónica con disminución progresiva del rango de movimiento, dolor e hinchazón. Debido a que el diagnóstico a menudo se retrasa, el pronóstico es pobre.
Diagnóstico
El diagnóstico es fácil cuando un paciente presenta una esporotricosis linfocutánea clásica, ya que las características clínicas son muy sugestivas. Sin embargo, el diagnóstico de las formas menos clásicas de esporotricosis, como la enfermedad osteoarticular o visceral, casi siempre se retrasa.
El cultivo es el estándar de oro para establecer el diagnóstico de esporotricosis y también es el método más sensible. El material aspirado de una lesión, una muestra de una biopsia de tejido, esputo o fluidos corporales debe inocularse en agar dextrosa de Sabouraud e incubarse a temperatura ambiente. La incubación a esta temperatura facilita el crecimiento de la fase micelial de S. schenckii con la disposición característica de los conidios en las hifas.
El crecimiento generalmente aparece dentro de cinco días, pero a veces puede tomar varias semanas. Para garantizar que el hongo sea S. schenckii, la fase de moho debe convertirse a la fase de levadura en agar sangre a 37 ° C.
Tratamiento
Itraconazol es el fármaco de elección para el tratamiento de la esporotricosis linfocutánea y cutánea. La dosis habitual es de 100 a 200 mg/día por vía oral, y el tratamiento debe continuarse de dos a cuatro semanas después de que se hayan resuelto todas las lesiones, generalmente durante un total de tres a seis meses. La tasa de éxito basada en estudios observacionales es del 90 al 100%. Se recomienda la dosis de 200 mg, ya que algunos pacientes no responderán a la dosis más baja y requerirán de todos modos una intensificación de la dosis.
La hipertermia local, inducida por una variedad de diferentes dispositivos de calentamiento o baños, también se ha usado con éxito y con efectos secundarios mínimos para la esporotricosis cutánea. La terapia de calor podría usarse, por ejemplo, en una paciente embarazada con esporotricosis cutánea y que no puede tratarse con seguridad con ninguno de los medicamentos orales que son útiles para la esporotricosis.
Esporotricosis Osteoarticular
Casi todos los pacientes con esporotricosis osteoarticular pueden tratarse con itraconazol, ya que la infección suele ser crónica y localizada. La dosis mínima es de 200 mg c. 12 hrs., y la terapia debe continuar durante al menos un año. Los niveles séricos de itraconazol deben revisarse después de que el paciente haya tomado el medicamento durante al menos dos semanas para asegurar niveles adecuados. Incluso si la infección se cura, el resultado funcional después de la artritis por S. schenckii a menudo es deficiente.
La anfotericina B se recomienda en pacientes con enfermedad extensa como terapia inicial y en aquellos que no han respondido al itraconazol. Se prefiere una formulación lipídica a una dosis de 3 a 5 mg/kg por día por vía intravenosa debido a la nefrotoxicidad reducida en comparación con anfotericina B desoxicolato. El uso de anfotericina B desoxicolato (0.7 a 1 mg/kg por día por vía intravenosa) puede considerarse en pacientes sin factores de riesgo de insuficiencia renal debido a su menor costo.
Histoplasmosis
La histoplasmosis es una micosis endémica común que, por lo general, es asintomática pero ocasionalmente produce una enfermedad grave. La histoplasmosis y su agente causal, Histoplasma capsulatum, se encuentran en todo el mundo, pero particularmente en América del Norte y Central. H. capsulatum prolifera en suelos contaminados con excrementos de pájaros o murciélagos, que se cree que alteran las características del suelo favoreciendo la esporulación del organismo.
Los sitios comúnmente asociados con la exposición a H. capsulatum incluyen gallineros o edificios agrícolas con grandes acumulaciones de excrementos de gallinas, edificios abandonados, lugares de gallineros, cuevas y lotes de madera. Las actividades que se han asociado con la exposición incluyen excavación, construcción, demolición, remodelación, corte y recolección de madera, exploración de cuevas y campamentos que están visiblemente contaminados con guano de murciélago.
La exposición intensa generalmente ocurre con las actividades en lugares con una gran acumulación de excrementos dentro de un área cerrada, como una cueva o un ático. Sin embargo, en muchos casos, los pacientes no recuerdan tal exposición.
Etiopatogenia
Los pulmones proporcionan el portal de entrada para H. capsulatum en la gran mayoría de los casos. Con raras excepciones la transmisión ocurre desde un órgano infectado en pacientes que han sido sometidos a trasplante o a través de una la lesión punzocortante en personas que trabajan con el organismo en el laboratorio. Los conidios o fragmentos de micelios se inhalan y, si evaden las defensas no específicas del pulmón, causan una bronconeumonía localizada o en parches. El espectro clínico de la histoplasmosis aguda varía según el grado de exposición, la presencia de enfermedad pulmonar subyacente, el estado inmunológico general y la inmunidad específica contra H. capsulatum. Con una exposición baja al inóculo, la mayoría de las personas sanas se mantienen asintomáticas.
Sin embargo, los pacientes que inhalan un inóculo grande pueden desarrollar una infección pulmonar difusa aguda grave y potencialmente mortal. Los macrófagos inicialmente pueden ingerir pero no matar a los hongos. Los macrófagos infectados sirven para diseminar la infección por vía hematógena durante las dos primeras semanas de infección, antes de que se haya desarrollado la inmunidad específica. La diseminación suele ser clínicamente silente y puede dar como resultado el desarrollo de granulomas que contienen H. capsulatum en el hígado y el bazo, que luego pueden descubrirse de manera incidental en la tomografía computarizada (TAC) o en la autopsia.
La diseminación progresiva clínicamente evidente ocurre principalmente en pacientes con trastornos inmunosupresores subyacentes, aquellos en los extremos de la vida o pacientes que han experimentado una exposición inusualmente fuerte. La inmunidad celular a H. capsulatum se desarrolla aproximadamente de 10 a 14 días después de la exposición; es demostrable primero en los pulmones y los ganglios linfáticos mediastínicos y luego en todo el sistema reticuloendotelial. Los linfocitos T sensibilizados activan los macrófagos para desarrollar propiedades fungicidas, y la infección se controla en los huéspedes inmunocompetentes.
El factor de necrosis tumoral (TNF) y el interferón gamma desempeñan papeles críticos en la defensa contra H. capsulatum. La enfermedad progresiva con infección pulmonar y extrapulmonar se produce en ausencia de inmunidad celular intacta. La histoplasmosis es la infección micótica más común observada en pacientes que son tratados con inhibidores del TNF-α. La infección tiende a ser agresiva y la diseminación ocurre en la mayoría de los pacientes.
Presentación Clínica
Menos del 5% de las personas expuestas desarrollan enfermedad sintomática después de un bajo nivel de exposición a H. capsulatum. La histoplasmosis pulmonar asintomática es el síndrome más común después de la infección. En la mayoría de los pacientes, la enfermedad se presenta como una infección pulmonar subaguda semanas o meses después de la exposición. Los síntomas generalmente son leves y los eventos que causan la exposición son difíciles de identificar. Las radiografías generalmente muestran infiltrados focales y linfadenopatía mediastínica o hiliar. La histoplasmosis a menudo se confunde con una neumonía adquirida en la comunidad y solo se considera después de que no haya respuesta a la terapia antibacteriana empírica.
Por lo general, la fiebre, escalofríos, cefalea, mialgias, anorexia, tos y el dolor en el pecho se desarrollan entre dos y cuatro semanas después de la exposición, pero se pueden observar posterior a una semana en los casos más expuestos. La coriza y el dolor de garganta no son típicos de la histoplasmosis y deben sugerir diagnósticos alternativos. El dolor en el pecho suele describirse como subesternal y, a menudo, se ve agravado por una inspiración profunda; los pacientes pueden experimentar dolor pleurítico si las lesiones colindan con la pleura. El examen físico generalmente no es relevante excepto por la fiebre, pero puede revelar estertores a la auscultación y evidencia de consolidación.
Los síntomas generalmente desaparecen al cabo de varias semanas, pero la fatiga y la astenia pueden persistir durante meses, especialmente en pacientes con manifestaciones iniciales más graves. Patológicamente, la lesión pulmonar se caracteriza por una bronconeumonía lobular o acinar, inicialmente con infiltración neutrofílica. El reclutamiento de macrófagos, linfocitos y células plasmáticas, y la formación de granulomas con células gigantes conspicuas ocurren a partir de la segunda semana; la necrosis caseosa central ocurre más tarde durante el segundo mes.
Hallazgos en la Radiografía de Tórax
Las radiografías de tórax generalmente muestran ganglios linfáticos hiliares o mediastínicos agrandados con infiltrados focales. Los infiltrados pulmonares generalmente son irregulares o nodulares; rara vez se observa cavitación en los infiltrados pulmonares, excepto en personas con enfermedad pulmonar obstructiva subyacente. Los infiltrados pueden ser difusos o miliares después de una exposición intensa. Los nódulos miden entre 1 y 4 cm de diámetro y a menudo son múltiples. Es de destacar que los infiltrados difusos pulmonares en un paciente inmunosuprimido generalmente representan una infección progresiva diseminada.

Los derrames pleurales se observan en una minoría de pacientes con histoplasmosis pulmonar aguda, y los organismos rara vez se aíslan del líquido pleural. La experiencia anecdótica sugiere que en la mayoría de las personas el cuadro remite claramente dentro de dos a cuatro meses, mientras que la adenopatía puede persistir durante años. La calcificación de los ganglios mediastínicos o las lesiones parenquimatosas se puede observar mediante radiografía de tórax en unos pocos meses en los niños, pero por lo general tardan varios años en desarrollarse en los adultos.
Cuándo Sospechar de Histoplasmosis
Los hallazgos clínicos de la histoplasmosis son variados y la enfermedad debe considerarse en las siguientes presentaciones clínicas, particularmente en el entorno epidemiológico apropiado:
- Neumonía con linfadenopatía mediastínica o hiliar.
- Masa mediastínica o hiliar sugestiva de neoplasia o tuberculosis.
- Nódulo pulmonar sugestivo de neoplasia.
- Enfermedad pulmonar cavitaria sugestiva de tuberculosis.
- Pericarditis con linfadenopatía mediastínica.
- Manifestaciones pulmonares con artritis o artralgia más eritema nodoso.
- Sospecha de sarcoidosis.
- Disfagia causada por estrechamiento esofágico.
- Síndrome de vena cava superior u obstrucción de otras estructuras mediastínicas.
Estas manifestaciones ubican a la histoplasmosis pulmonar en el diagnóstico diferencial de la neumonía adquirida en la comunidad, sarcoidosis, tuberculosis y neoplasias. Por tanto, las pruebas diagnósticas de histoplasmosis deben incluirse en pacientes que se encuentran en evaluación para estas afecciones cuando exista el antecedente epidemiológico apropiado.
Diagnóstico
En la enfermedad pulmonar aguda difusa la carga fúngica a menudo es alta en pacientes con infiltrados difusos que se presentan dentro de un mes después de la exposición a un alto inóculo de conidios. En tales casos, las pruebas de antígenos y anticuerpos proporcionan la mayor sensibilidad. La detección del antígeno usando el inmunoensayo de enzimático de detección de antígenos de Histoplasma en la orina, sangre o el líquido de lavado broncoalveolar de pacientes infectados proporciona información de diagnóstico rápido y es particularmente útil en pacientes que están gravemente enfermos.
Es posible que se necesite una broncoscopia o una biopsia pulmonar para establecer el diagnóstico en algunos casos en los que las pruebas menos invasivas no son diagnósticas o la enfermedad es demasiado grave como para esperar los resultados del antígeno o la prueba de anticuerpos. En tales casos, la patología y/o el cultivo son positivos en aproximadamente el 40% de los pacientes.
Serología
En la enfermedad pulmonar aguda localizada las pruebas serológicas para anticuerpos son positivas en más del 90% de los casos, pudiendo realizar pruebas de inmunodifusión y de fijación del complemento. La prueba de fijación del complemento que utiliza antígenos de la levadura y las formas miceliales de H. capsulatum es ligeramente más sensible (95%) que la prueba de inmunodifusión (90%).
En los casos agudos, los anticuerpos generalmente aparecen durante el segundo mes después de la exposición y, por tanto, pueden ser negativos cuando se miden por primera vez. Los anticuerpos pueden permanecer positivos durante varios años y pueden no indicar actividad de la enfermedad. La serología también ha demostrado ser útil para diferenciar la histoplasmosis de una neoplasia en la evaluación de nódulos pulmonares.
Histoplasmosis pulmonar cavitaria crónica
La serología es positiva en la mayoría de los casos, y los títulos de fijación del complemento a menudo son altos. La mayoría de los pacientes pueden expectorar el esputo, pero algunos pueden requerir una broncoscopia para obtener muestras adecuadas. Si no se puede obtener esputo, los cultivos son negativos, los títulos de fijación del complemento son bajos (1: 8 o 1:16), o si se sospecha otro diagnóstico (p.e. cáncer de pulmón o infección por micobacterias), se debe realizar una broncoscopia. Las muestras de esputo o broncoscopia son positivas en 65 a 85% de los casos.
Tratamiento
El tratamiento óptimo para la histoplasmosis varía de acuerdo con el síndrome clínico del paciente. La mayoría de las infecciones causadas por H. capsulatum son autolimitadas y no requieren tratamiento. Sin embargo, los pacientes que están expuestos a un inóculo grande de Histoplasma y aquellos que están inmunocomprometidos generalmente requieren terapia antimicótica. Generalmente se prefiere el itraconazol para la histoplasmosis leve a moderada, y la anfotericina B tiene un papel en el tratamiento de las infecciones moderadamente graves y graves.
El tratamiento está indicado en la mayoría de los pacientes con infiltrados pulmonares difusos que se presentan dentro de un mes de exposición a un inóculo grande de H. capsulatum y en todos los pacientes que tienen enfermedad moderadamente grave o grave. Los pacientes con disnea e hipoxemia y/o desarrollo de síndrome de dificultad respiratoria aguda (SDRA) deben tratarse inicialmente con anfotericina B. La adición de metilprednisolona (0,5 a 1,0 mg/kg/día IV.) durante una o dos semanas se ha utilizado en algunos pacientes con beneficio clínico.
La mejoría clínica es a menudo dramática y puede ocurrir al par de días del inicio de tratamiento, lo que permite una transición rápida a itraconazol para completar un ciclo de tratamiento de doce semanas. Se debe considerar el tratamiento en pacientes sintomáticos que presenten infiltrados localizados y/o linfadenopatía mediastínica y que no muestren mejoría después de cuatro semanas de síntomas. No se sabe si el tratamiento altera el curso de la enfermedad en tales casos.
Tratamiento de la Enfermedad Crónica
El tratamiento está indicado en todos los pacientes con histoplasmosis pulmonar crónica porque la infección produce una pérdida progresiva de la función pulmonar en la mayoría de los pacientes y la muerte en hasta un 30% de los casos. La anfotericina B puede detener la progresión de la enfermedad y reduce significativamente la mortalidad. Estudios posteriores han demostrado la eficacia del tratamiento con itraconazol. Este fármaco debe administrarse con una dosis de carga (200 mg por vía oral tres veces al día durante los primeros tres días) seguido de una dosis de mantenimiento (200 mg por vía oral una o dos veces al día) durante al menos un año.
Algunos expertos prefieren 18 a 24 meses de terapia antifúngica dado el riesgo sustancial de recaída. Las anormalidades radiográficas mejoran durante el primer año de tratamiento en al menos dos tercios de los casos, pero a menudo no se resuelven por completo. El tratamiento no debe suspenderse hasta que los hallazgos radiográficos se hayan estabilizado.
Coccidiomicosis
La coccidioidomicosis es la infección causada por los hongos dimórficos del género Coccidioides (Coccidioides immitis y Coccidioides posadasii). La mayoría de las infecciones son causadas por la inhalación de esporas. La expresión clínica de la enfermedad varía desde la neumonía aguda autolimitada (fiebre del valle) hasta la enfermedad diseminada, especialmente en pacientes inmunosuprimidos.
Coccidioides spp son endémicas de ciertos desiertos del hemisferio occidental, incluidos el sur de Arizona, los valles meridionales y centrales de California, el suroeste de Nuevo México y el oeste de Texas en los Estados Unidos. También se encuentran en partes de México y América Central y del Sur. Las estimaciones del riesgo de exposición endémica a Coccidioides spp son de aproximadamente 3% por año. El riesgo de exposición dentro de las regiones endémicas es estacional, generalmente el más alto ocurre en los períodos secos después de la estación de lluvias.
Presentación Clínica
Se estima que menos de la mitad de todos los casos acuden a atención médica debido a que la enfermedad a menudo es subclínica. La proporción de infecciones que se vuelven clínicamente significativas aumenta en los brotes con una exposición más intensa al polvo. Se presume que esto representa una mayor exposición al inóculo artroconidial, como ocurre durante las excavaciones arqueológicas o las maniobras militares en el desierto. Para aquellos que desarrollan síntomas, es probable un amplio espectro de manifestaciones clínicas.
La infección primaria debida a las especies de Coccidioides se manifiesta con mayor frecuencia como una neumonía adquirida en la comunidad (NAC) aproximadamente de 7 a 21 días después de la exposición. Los síntomas de presentación más comunes son dolor en el pecho, tos y fiebre. Si se produce hemoptisis, sugiere el desarrollo de una cavitación pulmonar. Los pacientes con infección coccidioidal temprana también pueden presentar manifestaciones dermatológicas o reumatológicas. La referencia frecuente de artralgias ha contribuido al nombre de “reumatismo del desierto” para esta enfermedad.
Las manifestaciones cutáneas de la infección coccidioidal primaria incluyen eritema nodoso y eritema multiforme. El eritema nodoso es mucho más común en las mujeres que en los hombres, y con frecuencia es el síntoma que hace sugerente el diagnóstico de la fiebre del valle.
Diagnóstico
Es principalmente clínico, dado que, tanto los estudios de laboratorio como los de imagen, no suelen mostrar datos característicos. Considera el diagnóstico de coccidioidomicosis en pacientes con una exposición endémica y enfermedad respiratoria de más de una semana de duración, especialmente si parece involucrar al tracto respiratorio inferior (es decir, neumonía adquirida en la comunidad). También se debe sospechar infección coccidioidal primaria en pacientes con una exposición endémica que presentan artralgias simétricas difusas y eritema nodoso o eritema multiforme.
En la mayoría de los casos, el período de incubación para el inicio de los síntomas es de 7 a 21 días. Sin embargo, en pacientes inmunocomprometidos debido al SIDA, trasplante de órgano sólido o linfoma, la reactivación puede ocurrir después de períodos de tiempo mucho más largos. La mayoría de los pacientes ambulatorios con sospecha de coccidioidomicosis son evaluados mediante pruebas serológicas. El aislamiento de las especies de Coccidioides en cultivo establece el diagnóstico definitivo. Además, el frotis con preparación de hidróxido de potasio (KOH) o tinción blanca de calcoflúor también puede ser de utilidad.
Tratamiento
La mayoría de los pacientes inmunocompetentes con infección coccidioidal primaria no requieren terapia antifúngica; sin embargo, el tratamiento debe administrarse a aquellos con enfermedad grave y aquellos con un riesgo mucho mayor de diseminación debido a inmunosupresión importante o embarazo. Además, todos los pacientes con infección coccidioidal primaria (independientemente de los síntomas de gravedad) deben ser seguidos durante un año o más para evaluar el desarrollo de complicaciones.
Es recomendable indicar terapia antifúngica a pacientes con enfermedad grave y aquellos con mayor riesgo de diseminación o complicaciones. Aunque no existen estudios aleatorizados para determinar si la terapia antifúngica acorta el curso de la enfermedad o previene las complicaciones, es posible que algunos pacientes se beneficien con el tratamiento. Los indicadores comúnmente utilizados para enfermedad grave incluyen:
- Más del 10% de pérdida de peso corporal.
- Sudoración nocturna que persiste por más de tres semanas.
- Infiltrados que afectan a más de la mitad de un pulmón o porciones de ambos pulmones
- Adenopatía hiliar prominente o persistente.
- Concentraciones de anticuerpos fijadores de complemento anticoccidioidal superiores a 1:16.
- Incapacidad para trabajar.
- Síntomas que persisten por más de dos meses.
Para la mayoría de los pacientes (y mujeres no embarazadas), está indicado fluconazol (400 mg diarios) o itraconazol (200 mg dos veces al día). No hay consenso con respecto a la duración del tratamiento; sin embargo, generalmente se trata a pacientes sin inmunodepresión subyacente grave durante tres a seis meses. La anfotericina B debe considerarse únicamente en los casos más graves de neumonía coccidioidal debido a su toxicidad y problemas con la administración.
Aspergilosis
Se considera al Aspergillus fumigatus como la especie más frecuentemente involucrada. Se trata de hongos ambientales y, aunque pueden crecer en cualquier tejido o fluido corporal, la colonización ocurre con mayor frecuencia en tejido subcutáneo o mucosas. Se distinguen cuatro presentaciones clínicas de la aspergilosis.
Aspergilosis Broncopulmonar Alérgica
La aspergilosis broncopulmonar alérgica es una reacción de hipersensibilidad compleja en respuesta a la colonización de las vías respiratorias con Aspergillus fumigatus que ocurre casi exclusivamente en pacientes con asma o fibrosis quística. El cuadro clínico está dominado por el asma y las exacerbaciones recurrentes. En casos graves, pueden presentarse episodios de obstrucción bronquial, fiebre, malestar general, expectoración de tapones mucosos parduscos y, a veces, hemoptisis.
Las sibilancias no siempre son evidentes, y algunos pacientes presentan consolidación pulmonar asintomática. En casos crónicos, los episodios repetidos de obstrucción bronquial, inflamación e impactación mucoide pueden provocar bronquiectasias, fibrosis y compromiso respiratorio. Los hallazgos de laboratorio incluyen un recuento elevado de eosinófilos en sangre (generalmente> 500 células/μL), IgE sérica total elevada (generalmente> 1000 UI/ml), anticuerpos IgG precipitantes (precipitinas) frente a Aspergillus y anticuerpos IgE e IgG específicos contra Aspergillus en inmunoensayo. El esputo expectorado puede contener “tapones” con eosinófilos, cristales de Charcot-Leyden y puede crecer Aspergillus en cultivo.
La radiografía de tórax puede mostrar opacidades parenquimatosas (que generalmente involucran a los lóbulos superiores), atelectasia debido a la impactación mucoide y una serie de hallazgos característicos de las bronquiectasias. La tomografía computarizada de alta resolución del tórax puede mostrar una bronquiectasia cilíndrica proximal extendida con predominio del lóbulo superior y engrosamiento de la pared bronquial.
Tratamiento
El tratamiento de la aspergilosis broncopulmonar alérgica tiene como objetivo controlar los episodios de inflamación aguda y limitar la lesión pulmonar progresiva. La función de los glucocorticoides sistémicos y los agentes antifúngicos varían con la actividad de la enfermedad. La terapia antifúngica puede ayudar a disminuir las exacerbaciones. Los glucocorticoides inhalados pueden ayudar a controlar los síntomas del asma, pero no tienen una eficacia documentada para prevenir los episodios agudos.
En el caso de una presentación aguda con opacidades radiográficas (generalmente lóbulos superiores o medios) y una IgE sérica total elevada (generalmente> 1000 UI/ml), los glucocorticoides sistémicos son la base del tratamiento. Además, las guías del 2016 de la Sociedad Americana de Enfermedades Infecciosas (IDSA) sobre el tratamiento de la aspergilosis recomiendan que el tratamiento de la presentación aguda o recurrente deba consistir en una combinación de glucocorticoides e itraconazol. El voriconazol es una alternativa razonable al itraconazol porque se tolera mejor en algunos pacientes y se absorbe bien.
Aspergiloma
El aspergiloma es una lesión fúngica redonda que coloniza una cavitación pulmonar preexistente, por lo general secundaria a una lesión tuberculosa. Los criterios para el diagnóstico de aspergiloma son la evidencia radiológica de una masa redondeada en una cavidad pulmonar, combinada con evidencia microbiológica de Aspergillus como agente causal, generalmente un cultivo positivo de esputo o IgG de Aspergillus detectable.
Dado que los aspergilomas pueden aparecer en el contexto de la aspergilosis pulmonar cavitaria crónica, la distinción entre un aspergiloma simple y la aspergilosis pulmonar cavitaria crónica depende de la sintomatología, la evidencia de inflamación, la apariencia radiológica y el cambio a lo largo del tiempo. Si el aspergiloma es único, la cavidad se mantiene estable durante meses y el paciente tiene pocos síntomas (es decir, una tos leve solamente) y poca evidencia de inflamación sistémica.
Tratamiento
La resección quirúrgica se ofrece con el fin de prevenir o tratar la hemoptisis, potencialmente mortal, y generalmente es curativa. <span title="In patients with good respiratory function, no other significant contraindications to thoracotomy, and disease limited to one lobe, the 30-day operative mortality is <5 percent and, in recent series, En pacientes con buena función respiratoria, sin otras contraindicaciones significativas para la toracotomía y enfermedad limitada a un lóbulo, la mortalidad postoperatoria a 30 días es <5% y, en series recientes, <1% en centros que tienen experiencia importante con esta enfermedad.
Las infecciones recurrentes, contraindicaciones para el tratamiento con azoles, la resistencia a estos fármacos y las infecciones o tumores concurrentes representan indicaciones adicionales para la resección quirúrgica pero conllevan un mayor riesgo. La embolización es apropiada en pacientes seleccionados y puede usarse antes de la cirugía para estabilizar al paciente. El tratamiento antimicótico pre y posoperatorio (por lo general, voriconazol) es apropiado para minimizar el riesgo de aspergilosis pleural postoperatoria, en caso de que la cavidad se abra inadvertidamente durante la cirugía y provoque un derrame.
Aspergilosis Pulmonar Invasiva Subaguda
La aspergilosis pulmonar invasiva subaguda (antes aspergilosis necrotizante crónica) ocurre en adultos mayores con comórbidos, p.e. EPOC o sarcoidosis. En la radiografía se visualizan infiltrados crónicos de localización en los lóbulos superiores y engrosamiento pleural, pudiendo evolucionar las lesiones hacia una cavitación. Debido a la lenta evolución del cuadro, el paciente desarrolla anticuerpos frente a Aspergillus, lo que permite su detección mediante serología.
Los criterios para el diagnóstico de la aspergilosis pulmonar invasiva subaguda son similares a los de la aspergilosis pulmonar invasiva, pero la forma subaguda progresa más lentamente que la forma aguda (más de 1 a 3 meses versus más de 0 a 4 semanas). Los pacientes pueden tener antígeno detectable de Aspergillus (galactomanano) o Aspergillus IgG en la sangre. La confirmación requiere biopsia de la lesión pulmonar.
Tratamiento
La aspergilosis pulmonar invasiva subaguda se trata con antifúngicos, de preferencia voriconazol. El enfoque de la terapia antifúngica es similar al enfoque de la aspergilosis invasiva aguda. La embolización puede estar indicada en ciertos pacientes para tratar la hemoptisis. La resección quirúrgica no suele contemplarse debido al estado general de salud del paciente y la escasa reserva respiratoria.
Aspergilosis Pulmonar Invasiva
Por último, la aspergilosis pulmonar invasiva es la presentación más grave de esta infección. Se presenta en paciente inmunocomprometidos, en especial en neutropénicos. En estos casos, es el propio hongo filamentoso el que invade el parénquima pulmonar, ocasionando un cuadro acompañado de imagen de neumonía cavitada y el característico signo “del halo” en la radiografía. La aspergilosis invasiva ocurre con mayor frecuencia en los pulmones o los senos paranasales después de la inhalación de conidios, aunque, con menor frecuencia, la enfermedad puede diseminarse desde el tracto gastrointestinal o ser el resultado de una inoculación directa en la piel.
Los pacientes pueden presentar fiebre, dolor en el pecho, dificultad para respirar, tos y/o hemoptisis. La tríada clásica que se ha descrito en pacientes neutropénicos con aspergilosis pulmonar es fiebre, dolor pleurítico en pecho y hemoptisis. Sin embargo, la ausencia de esta tríada no debe desalentar la consideración de este diagnóstico ante factores de riesgo ya que los pacientes neutropénicos con frecuencia presentan fiebre en ausencia de síntomas pulmonares localizadores. En tales pacientes, las imágenes de pulmón a menudo revelan nódulos y/o infiltrados pulmonares.
La aspergilosis pulmonar se manifiesta típicamente como nódulos únicos o múltiples con o sin cavitación, consolidación fragmentada o segmentaria, o infiltrados peribronquiales con o sin patrones de ramificación. Los hallazgos radiográficos, como con las manifestaciones de la enfermedad, pueden ser variables y dependen en gran medida del huésped. La progresión radiográfica de la enfermedad se ha estudiado mejor en pacientes neutropénicos en quienes los hallazgos iniciales suelen incluir nódulos que tienen infiltrados de vidrio esmerilado circundantes (el signo del halo), y que reflejan una hemorragia en el área circundante al hongo. Estos nódulos generalmente se agrandan, incluso con tratamiento apropiado, y pueden eventualmente cavitar, produciendo el signo de la media luna creciente.
Tratamiento
El manejo óptimo implica el diagnóstico precoz y el inicio temprano de la terapia antifúngica. Además de la terapia antifúngica, se debe considerar la cirugía para pacientes con ciertas manifestaciones. La reducción de la inmunosupresión, cuando es posible, es otro componente importante del manejo. Para el tratamiento inicial de la aspergilosis invasiva severa diagnosticada por cultivo, antígeno galactomanano o histopatología, se recomienda una terapia de combinación con voriconazol y una equinocandina.
Sin embargo, algunos expertos prefieren la monoterapia con voriconazol debido a la ausencia de datos definitivos. La decisión de administrar una terapia combinada debe sopesarse contra el riesgo de toxicidad y la viabilidad de la terapia intravenosa. Para los pacientes que no toleran voriconazol debido a reacciones graves, se puede indicar una formulación lipídica de anfotericina B (p. Ej., AmBisome o Abelcet) o isavuconazol.
Mucormicosis
La mucormicosis se manifiesta por una variedad de distintos síndromes en humanos, particularmente en pacientes inmunocomprometidos y aquellos con diabetes mellitus. Las infecciones rino-órbito-cerebrales y pulmonares devastadoras son los síndromes más comunes causados por estos hongos. Estos organismos son de naturaleza omnipresente y se pueden encontrar en la vegetación en descomposición y en el suelo. Estos hongos crecen rápidamente y liberan grandes cantidades de esporas que pueden ser transportadas por el aire. Los géneros más comúnmente encontrados en las infecciones humanas son Rhizopus, Mucor y Rhizomucor
Los Rhizopus tienen una enzima, la cetona reductasa, que les permite prosperar en condiciones ácidas y niveles elevados de glucosa. El suero de individuos sanos inhibe el crecimiento de Rhizopus, mientras que el de individuos con cetoacidosis diabética estimula el crecimiento. La mucormicosis rino-órbito-cerebral y pulmonar se adquiere por inhalación de esporas. En individuos sanos, los cilios transportan estas esporas a la faringe y se limpian a través del tracto gastrointestinal. En individuos susceptibles, la infección generalmente comienza en los cornetes nasales o los alvéolos.
Los patógenos causantes de la mucormicosis son angioinvasivos; por tanto, el infarto de tejidos infectados es un sello distintivo de la enfermedad invasiva. Casi todos los pacientes con mucormicosis invasiva tienen alguna enfermedad subyacente que predispone a la infección e influye en la presentación clínica. Las enfermedades subyacentes más comunes son:
- Diabetes mellitus, particularmente con cetoacidosis
- Tratamiento con glucocorticoides
- Neoplasias malignas hematológicas
- Trasplante de células hematopoyéticas
- Trasplante de órgano sólido
- Tratamiento con deferoxamina
- Sobrecarga de hierro
- SIDA
- Uso de drogas inyectables
- Trauma o quemaduras
- Desnutrición
Presentación Clínica
La presentación clínica más común de la mucormicosis es la infección rino-órbito-cerebral, que se supone comienza con la inhalación de esporas en los senos paranasales de un huésped susceptible. La hiperglucemia, generalmente con una acidosis metabólica asociada, es la afección subyacente más común. Una revisión de 179 casos de mucormicosis rino-órbito-cerebral encontró que 126 (70%) de los pacientes tenían diabetes mellitus y que la mayoría tenía cetoacidosis en el momento de la presentación.
La infección generalmente se presenta como rinosinusitis aguda con fiebre, congestión nasal, secreción nasal purulenta, cefalea y dolor sinusal. Todos los senos se involucran y se diseminan a estructuras contiguas, como el paladar, la órbita y el cerebro, por lo general progresan rápidamente. Las características distintivas de la diseminación más allá de los senos son la necrosis tisular del paladar que produce escaras palatinas, destrucción de los cornetes, edema perinasal con eritema y cianosis de la piel facial que recubre los senos y/o la órbita afectados. Una escara negra, que resulta de la necrosis de los tejidos después de la invasión vascular por el hongo, puede ser visible en la mucosa nasal, el paladar o la piel que recubre la órbita.

Los signos de afectación orbitaria incluyen edema periorbitario, proptosis y ceguera. El entumecimiento facial es frecuente y es el resultado del infarto de las ramas sensoriales del quinto par craneal. La propagación de la infección del seno etmoidal al lóbulo frontal produce obnubilación. La diseminación de los senos esfenoides al seno cavernoso adyacente puede provocar parálisis de los nervios craneales, trombosis del seno y afectación de la carótida. La diseminación hematógena a otros órganos es rara a menos que el paciente tenga una neoplasia hematológica subyacente con neutropenia.
Diagnóstico
El diagnóstico de mucormicosis se basa en la identificación de organismos en el tejido por histopatología con confirmación mediante cultivo. Sin embargo, el cultivo a menudo no produce crecimiento y la identificación histopatológica de un organismo con una estructura típica de Mucorales puede proporcionar la única evidencia de infección. Piensa en esta entidad en un entorno clínico apropiado y en caso necesario realiza pruebas invasivas para establecer un diagnóstico lo antes posible.
Por otro lado, los Mucorales pueden colonizar las vías respiratorias o ser contaminantes en cultivos, y el aislamiento de estos hongos en un cultivo no necesariamente prueba la infección. La interpretación de los resultados del cultivo en el contexto de los signos y síntomas del paciente y la enfermedad subyacente son necesarios para determinar si se debe administrar una terapia antifúngica.
Se debe realizar una evaluación endoscópica de los senos para buscar la necrosis tisular y obtener muestras. Éstas deben evaluarse para detectar hifas amplias no septadas características con ramificación en ángulo recto usando calcofluor blanco y tinciones de plata metenamina. La presencia de las hifas características en una muestra clínica proporciona un diagnóstico presuntivo. Sin embargo, la ausencia de hifas no descarta el diagnóstico de mucormicosis cuando el cuadro clínico es altamente sugestivo.
Tratamiento
El tratamiento de la mucormicosis implica una combinación de desbridamiento quirúrgico de los tejidos afectados y terapia antifúngica. La eliminación de los factores predisponentes para la infección, como la hiperglucemia, la acidosis metabólica, la suspensión de deferoxamina o fármacos inmunosupresores y la neutropenia, también es fundamental. La anfotericina B intravenosa (formulación lipídica) es el fármaco de elección para el tratamiento inicial.
El posaconazol o isavuconazol se usa como terapia de reducción para pacientes que han respondido a anfotericina B. El posaconazol o isavuconazol también se puede usar como terapia de rescate para pacientes que no responden o no pueden tolerar la anfotericina B; para la terapia de rescate, la decisión de usar posaconazol o isavuconazol por vía oral o intravenosa depende de qué tan enfermo esté el paciente, si se pudo administrar un curso inicial de anfotericina B y si el paciente tiene un tracto gastrointestinal (GI) funcional.
El desbridamiento quirúrgico agresivo de los tejidos afectados debe realizarse tan pronto como se sospeche el diagnóstico de cualquier forma de mucormicosis. En el caso de una infección rinocerebral, el desbridamiento para extirpar todo el tejido necrótico con frecuencia desfigurará y requerirá la eliminación del paladar, el cartílago nasal y la órbita. Hay informes de pacientes con infección pulmonar temprana que fueron curados con lobectomías. Sin embargo, muchos pacientes presentan una afectación multilobular que impide la resección quirúrgica. La infección aislada de los tejidos blandos debe desbridarse si la situación clínica lo permite.
Candidiasis
Las manifestaciones clínicas de la infección por especies de Candida varían desde infecciones locales de la membrana mucosa hasta diseminación generalizada con falla orgánica multisistémica. Aunque se considera que Candida es parte de la microbiota normal en los tractos gastrointestinal y genitourinario de los humanos, tienen la propensión a invadir y causar enfermedad cuando se crea un desequilibrio en el nicho ecológico en el que estos organismos existen habitualmente. La respuesta inmune del huésped es un determinante importante del tipo de infección causada por Candida.
- Las infecciones más benignas se caracterizan por sobrecrecimiento local en las membranas mucosas (afectación orofaríngea, vaginitis) como resultado de cambios en la flora normal. Se producen infecciones de membrana mucosa persistentes más extensas en individuos con deficiencias en la inmunidad mediada por células, como el SIDA.
- Las infecciones focales invasivas, como la pielonefritis, la endocarditis y la meningitis, ocurren con mayor frecuencia después de la diseminación hematógena o cuando existen anomalías o dispositivos anatómicos (por ejemplo, válvulas cardíacas protésicas o derivaciones del sistema nervioso central).
- En el huésped neutropénico o en el paciente gravemente enfermo en la unidad de cuidados intensivos, la diseminación visceral se produce cuando las especies de Candida obtienen acceso al torrente sanguíneo.
Las diferentes especies de Candida en general son capaces de producir todos los síndromes clínicos, aunque la infección por Candida albicans es la más común. Es importante identificar el organismo infectante porque algunas especies son más resistentes a los agentes antifúngicos azólicos que otras.
Presentación Clínica
La candidiasis orofaríngea, o aftas, es una infección local común que se observa en los bebés; adultos mayores que usan dentaduras postizas; pacientes tratados con antibióticos, quimioterapia o radioterapia en la cabeza y el cuello; y aquellos con estados de inmunodeficiencia celular, como el SIDA. Los pacientes con xerostomía y aquellos tratados con glucocorticoides inhalados para el asma o la rinitis también están en riesgo. La candidiasis esofágica es más común en pacientes infectados por VIH, en los que es una enfermedad definitoria del SIDA, y en pacientes con neoplasias malignas hematológicas.
La candidiasis vulvovaginal es la forma más común de candidiasis de las mucosas. Ocurre con mayor frecuencia en situaciones asociadas con niveles aumentados de estrógeno, como el uso de anticonceptivos orales y el embarazo. Los antibióticos, los glucocorticoides, la diabetes mellitus, la infección por VIH, los dispositivos intrauterinos y el uso del diafragma también son factores de riesgo. La candidiasis mucocutánea crónica es un síndrome raro que generalmente comienza en la infancia. Algunos pacientes tienen síndrome autoinmune poliglandular autosómico recesivo tipo I, que también se conoce como el síndrome de poliendocrinopatía autoinmune-candidiasis-distrofia ectodérmica.

La candidemia se refiere a la presencia de especies de Candida en sangre. Los huéspedes inmunocomprometidos y los pacientes en unidades de cuidados intensivos tienen el mayor riesgo de candidemia. La candidiasis hepatoesplénica (también llamada candidiasis diseminada crónica) se observa casi por completo en pacientes con neoplasias malignas hematológicas que acaban de recuperarse de un episodio de neutropenia. Algunos pacientes tienen un episodio previo documentado de candidemia; en otros, es probable que la invasión de especies de Candida ocurriera a través de la vasculatura portal. Las infecciones focales invasivas incluyen infección del tracto urinario, endoftalmitis, infecciones osteoarticulares, meningitis, endocarditis, peritonitis e infecciones intraabdominales, empiema, mediastinitis y pericarditis. La neumonía por Candida es extremadamente rara.
Diagnóstico
Las especies de Candida crecen adecuadamente en medios habituales para hongos y bacterias a 25-37ºC, generan colonias de consistencia mucosa o pastosa formadas por elementos levaduriformes ovoides con posibilidad de gemación. En medios de cultivo especiales, como el agar morfológico, se puede observar la formación de hifas o la presencia de estructuras largas y ramificadas llamadas pseudohifas. Cabe resaltar que C. glabrata no forma hifas ni pseudohifas.
Cándida albicans se puede identificar por formación de tubos germinales en suero humano y por la presencia de grandes esporas de pared gruesa llamadas chlamydosporas. El hallazgo de pseudohifas en el examen en fresco, aunado a un cultivo positivo es diagnóstico de candidiasis superficial. En las candidiasis profundas, el diagnóstico se realiza mediante examen directo, tinción o aislamiento mediante cultivo de muestras clínicas.
Tratamiento
El tratamiento de elección de la candidiasis superficiales es con fluconazol. Las alternativas de tratamiento, en especial en la candidemia grave o infección de tejidos profundos, constan de equinocandinas y anfotericina B. Cabe mencionar que el fluconazol no es activo frente a C. krusei y algunas cepas de C. glabrata, mientras que la anfotericina B no tiene actividad frente a C. lusitaniae. De ahí la importancia de identificar siempre la cepa particular infectante en el paciente.
Criptococosis
La criptococosis es una infección fúngica invasiva debida a Cryptococcus neoformans o Cryptococcus gattii que se ha vuelto cada vez más frecuente en pacientes inmunocomprometidos. C. neoformans es el principal miembro patógeno del género y tiene una distribución mundial. La gran mayoría de los pacientes con criptococosis están inmunocomprometidos debido a una de las siguientes condiciones (enumeradas en orden decreciente):
- SIDA
- Tratamiento prolongado con glucocorticoides
- Trasplante de órganos
- Neoplasias
- Hepatopatía
- Sarcoidosis
La infección diseminada de Cryptococcus neoformans es una infección oportunista grave que ocurre en pacientes con SIDA no tratado. Aunque la infección criptocócica comienza en los pulmones, la meningitis es la manifestación más frecuente de la criptococosis entre las personas con inmunosupresión avanzada. Sin embargo, la infección se caracteriza más como “meningoencefalitis” que como meningitis ya que el parénquima cerebral casi siempre está involucrado en el examen histológico. La gran mayoría de los casos de meningoencefalitis criptocócica se observan entre los pacientes con SIDA con recuento de CD4 <100 células/μL.
Presentación Clínica
Los síntomas de la meningoencefalitis criptocócica generalmente comienzan indolentemente durante un período de una a dos semanas. Los síntomas más comunes son fiebre, malestar general y cefalea. Rigidez de nuca, fotofobia y vómitos se observan en un cuarto a un tercio de los pacientes. Ocasionalmente, pueden presentar coma y muerte fulminante en cuestión de días. Otros síntomas que sugieren enfermedad diseminada incluyen tos, disnea y exantema. La pérdida visual y auditiva también se ha reportado.
La evaluación física inicial puede ser notable por letargo o confusión asociadoa a fiebre. En un informe, el 24% de los pacientes tenían alteración del estado mental en la presentación, y el 6% presentaba déficits neurológicos focales, como neuropatía craneal. Otras manifestaciones de la enfermedad diseminada pueden ser evidentes, incluyendo taquipnea y lesiones cutáneas que se asemejan al molusco contagioso. El aumento de la hipertensión diastólica puede ser reflejo del aumento de la presión intracraneal.
Diagnóstico
Los estudios generales de laboratorio son inespecíficos. Los pacientes con inmunosupresión avanzada pueden presentar leucopenia, anemia, hipoalbuminemia y una mayor fracción de anticuerpos gammaglobulina. Sospecha de meningoencefalitis criptocócica en pacientes con infección avanzada por VIH (recuento de células CD4 <100 células/ml) que tienen fiebre y cefalea aislados. La evaluación inicial incluye una historia clínica exhaustiva, examen neurológico y antígeno criptocócico sérico (CrAg). La evaluación también debe incluir una punción lumbar para evaluar el aumento de la presión intracraneal y el cultivo de líquido cefalorraquídeo (LCR) para confirmar el diagnóstico en aquellos con síntomas y/o un CrAg sérico positivo.
Antes de la punción lumbar, los pacientes con sospecha de aumento de la presión intracraneal y/o lesiones del sistema nervioso central (SNC) deben someterse a neuroimagen. Las imágenes pueden detectar la presencia de lesiones, aumento de la presión intracraneal y/o hidrocefalia, todo lo cual influye en las decisiones de tratamiento. El LCR debe enviarse para cultivo criptocócico; se pueden observar colonias mucoides de color crema en placas de agar generalmente dentro de tres a siete días.
El CrAg se puede detectar en suero y LCR a través de técnicas de inmunodiagnóstico, como la aglutinación de látex o el ensayo inmunoabsorbente ligado a enzimas (ELISA). La prueba de flujo lateral es un enfoque alternativo para detectar el antígeno criptocócico. Es una prueba sencilla de tira reactiva que no es costosa y puede usarse en muestras de orina, sangre, suero, líquido cefalorraquídeo o plasma. Esta última prueba es comparable con la aglutinación de látex y el ELISA. En entornos de recursos limitados, tiene el potencial de mejorar el acceso a las pruebas de diagnóstico.
Tratamiento
El tratamiento de la meningoencefalitis criptocócica incluye todo lo siguiente:
- Terapia antifúngica.
- Control de la presión intracraneal, que puede provocar ceguera, hernia, cefalea persistente y/o neuropatías si no se trata.
- Recuperación inmune con potentes medicamentos antirretrovirales.
Sin embargo, para reducir el riesgo de desarrollar un síndrome de reconstitución inmune, la terapia antirretroviral debe iniciarse entre 2 y 10 semanas después de que se haya iniciado la terapia antifúngica. No hay papel para los glucocorticoides empíricos durante la terapia de inducción. Esto está en contraste con otras afecciones (p.e meningitis tuberculosa), en las que los glucocorticoides se administran de forma rutinaria como parte del tratamiento inicial.
La terapia antifúngica implica tres fases: terapia de inducción durante aproximadamente dos semanas, seguida de terapia de consolidación durante ocho semanas más, y luego terapia de mantenimiento (es decir, supresiva) durante al menos un año para disminuir el riesgo de recaída. Los principales agentes antifúngicos utilizados para el tratamiento de la meningoencefalitis criptocócica incluyen anfotericina B intravenosa, flucitosina oral y fluconazol oral. No se recomienda el uso de anfotericina B intratecal o intraventricular, ya que la administración sistémica demuestra una buena eficacia y estas otras vías de administración pueden asociarse a aracnoiditis. Además, las equinocandinas no deben usarse para tratar esta infección, ya que no tienen actividad importante contra C. neoformans.
Referencias Bibliográficas
Greenberg HL, Shwayder TA, Bieszk N, Fivenson DP. Clotrimazole/betamethasone diproprionate: a review of costs and complications in the treatment of common cutaneous fungal infections. Pediatr Dermatol 2002; 19:78.
Rosen T, Elewski BE. Failure of clotrimazole-betamethasone dipropionate cream in treatment of Microsporum canis infections. J Am Acad Dermatol 1995; 32:1050.
Hawkins DM, Smidt AC. Superficial fungal infections in children. Pediatr Clin North Am 2014; 61:443.
Crawford F, Hollis S. Topical treatments for fungal infections of the skin and nails of the foot. Cochrane Database Syst Rev 2007; :CD001434.
Cho HR, Lee MH, Haw CR. Majocchi’s granuloma of the scrotum. Mycoses 2007; 50:520.
Tse KC, Yeung CK, Tang S, et al. Majocchi’s granuloma and posttransplant lymphoproliferative disease in a renal transplant recipient. Am J Kidney Dis 2001; 38:E38.
Kim ST, Baek JW, Kim TK, et al. Majocchi’s granuloma in a woman with iatrogenic Cushing’s syndrome. J Dermatol 2008; 35:789.
Akiba H, Motoki Y, Satoh M, et al. Recalcitrant trichophytic granuloma associated with NK-cell deficiency in a SLE patient treated with corticosteroid. Eur J Dermatol 2001; 11:58.
Cheng N, Rucker Wright D, Cohen BA. Dermatophytid in tinea capitis: rarely reported common phenomenon with clinical implications. Pediatrics 2011; 128:e453.
Romano C, Rubegni P, Ghilardi A, Fimiani M. A case of bullous tinea pedis with dermatophytid reaction caused by Trichophyton violaceum. Mycoses 2006; 49:249.
Al Aboud K, Al Hawsawi K, Alfadley A. Tinea incognito on the hand causing a facial dermatophytid reaction. Acta Derm Venereol 2003; 83:59.
BURKE RC. Tinea versicolor: susceptibility factors and experimental infection in human beings. J Invest Dermatol 1961; 36:389.
Faergemann J. Pityriasis versicolor. Semin Dermatol 1993; 12:276.
Hafez M, el-Shamy S. Genetic susceptibility in pityriasis versicolor. Dermatologica 1985; 171:86.
He SM, Du WD, Yang S, et al. The genetic epidemiology of tinea versicolor in China. Mycoses 2008; 51:55.
Savin R, Eisen D, Fradin MS, Lebwohl M. Tinea versicolor treated with terbinafine 1% solution. Int J Dermatol 1999; 38:863.
Vermeer BJ, Staats CC. The efficacy of a topical application of terbinafine 1% solution in subjects with pityriasis versicolor: a placebo-controlled study. Dermatology 1997; 194 Suppl 1:22.
Treatment of tinea versicolor with a new antifungal agent, ciclopirox olamine cream 1%. Clin Ther 1985; 7:574.
Sánchez JL, Torres VM. Double-blind efficacy study of selenium sulfide in tinea versicolor. J Am Acad Dermatol 1984; 11:235.
Faergemann J, Fredriksson T. Propylene glycol in the treatment of tinea versicolor. Acta Derm Venereol 1980; 60:92.
Prestia AE. Topical benzoyl peroxide for the treatment of tinea versicolor. J Am Acad Dermatol 1983; 9:277.
Hay RJ, Midgeley G. Short course ketoconazole therapy in pityriasis versicolor. Clin Exp Dermatol 1984; 9:571.
Zaias N. Pityriasis versicolor with ketoconazole. J Am Acad Dermatol 1989; 20:703.
Ward JI, Weeks M, Allen D, et al. Acute histoplasmosis: clinical, epidemiologic and serologic findings of an outbreak associated with exposure to a fallen tree. Am J Med 1979; 66:587.
Luby JP, Southern PM Jr, Haley CE, et al. Recurrent exposure to Histoplasma capsulatum in modern air-conditioned buildings. Clin Infect Dis 2005; 41:170.
Centers for Disease Control and Prevention (CDC). Histoplasmosis outbreak among day camp attendees–Nebraska, June 2012. MMWR Morb Mortal Wkly Rep 2012; 61:747.
Limaye AP, Connolly PA, Sagar M, et al. Transmission of Histoplasma capsulatum by organ transplantation. N Engl J Med 2000; 343:1163.
PROCKNOW JJ, PAGE MI, LOOSLI CG. Early pathogenesis of experimental histoplasmosis. Arch Pathol 1960; 69:413.
Kataria YP, Campbell PB, Burlingham BT. Acute pulmonary histoplasmosis presenting as adult respiratory distress syndrome: effect of therapy on clinical and laboratory features. South Med J 1981; 74:534.
Wynne JW, Olsen GN. Acute histoplasmosis presenting as the adult respiratory distress syndrome. Chest 1974; 66:158.
Horwath MC, Fecher RA, Deepe GS Jr. Histoplasma capsulatum, lung infection and immunity. Future Microbiol 2015; 10:967.
Chick EW, Bauman DS. Editorial: Acute cavitary histoplasmosis–fact or fiction? Chest 1974; 65:497.
Sathapatayavongs B, Batteiger BE, Wheat J, et al. Clinical and laboratory features of disseminated histoplasmosis during two large urban outbreaks. Medicine (Baltimore) 1983; 62:263.
Connell JV, Muhm JR. Radiographic manifestations of pulmonary histoplasmosis: a 10-year review. Radiology 1976; 121:281.
Quasney MW, Leggiadro RJ. Pleural effusion associated with histoplasmosis. Pediatr Infect Dis J 1993; 12:415.
Wheat LJ. Approach to the diagnosis of the endemic mycoses. Clin Chest Med 2009; 30:379.
Wheat LJ. Improvements in diagnosis of histoplasmosis. Expert Opin Biol Ther 2006; 6:1207.
Swartzentruber S, Rhodes L, Kurkjian K, et al. Diagnosis of acute pulmonary histoplasmosis by antigen detection. Clin Infect Dis 2009; 49:1878.
Lindsley MD, Holland HL, Bragg SL, et al. Production and evaluation of reagents for detection of Histoplasma capsulatum antigenuria by enzyme immunoassay. Clin Vaccine Immunol 2007; 14:700.
Tang YW, Li H, Durkin MM, et al. Urine polymerase chain reaction is not as sensitive as urine antigen for the diagnosis of disseminated histoplasmosis. Diagn Microbiol Infect Dis 2006; 54:283.
Nin CS, de Souza VV, do Amaral RH, et al. Thoracic lymphadenopathy in benign diseases: A state of the art review. Respir Med 2016; 112:10.
Goodwin RA Jr, Owens FT, Snell JD, et al. Chronic pulmonary histoplasmosis. Medicine (Baltimore) 1976; 55:413.
Loyd JE, Tillman BF, Atkinson JB, Des Prez RM. Mediastinal fibrosis complicating histoplasmosis. Medicine (Baltimore) 1988; 67:295.
Wheat LJ, Freifeld AG, Kleiman MB, et al. Clinical practice guidelines for the management of patients with histoplasmosis: 2007 update by the Infectious Diseases Society of America. Clin Infect Dis 2007; 45:807.
Johnson PC, Wheat LJ, Cloud GA, et al. Safety and efficacy of liposomal amphotericin B compared with conventional amphotericin B for induction therapy of histoplasmosis in patients with AIDS. Ann Intern Med 2002; 137:105.
Dismukes WE, Bradsher RW Jr, Cloud GC, et al. Itraconazole therapy for blastomycosis and histoplasmosis. NIAID Mycoses Study Group. Am J Med 1992; 93:489.
McKinsey DS, Kauffman CA, Pappas PG, et al. Fluconazole therapy for histoplasmosis. The National Institute of Allergy and Infectious Diseases Mycoses Study Group. Clin Infect Dis 1996; 23:996.
Park BJ, Sigel K, Vaz V, et al. An epidemic of coccidioidomycosis in Arizona associated with climatic changes, 1998-2001. J Infect Dis 2005; 191:1981.
Centers for Disease Control and Prevention. Valley Fever (Coccidioidomycosis) statistics.
Nesbit LA, Knox KS, Nguyen CT, et al. Immunological characterization of bronchoalveolar lavage fluid in patients with acute pulmonary coccidioidomycosis. J Infect Dis 2013; 208:857.
Sun SH, Cole GT, Drutz DJ, Harrison JL. Electron-microscopic observations of the Coccidioides immitis parasitic cycle in vivo. J Med Vet Mycol 1986; 24:183.
Cole GT, Sun SH. Arthroconidium – spherule – endospore transformation in Coccidioides immitis. In: Fungal Dimorphism, Szaniszlo PJ (Ed), Plenum Publishing Corporation, New York City 1985. p.281.
Goldstein DM, Louie S. Primary pulmonary coccidioidomycosis; report of an epidemic of 75 cases. War Med 1943; 4:299.
Colburn JR. Roentgenological types of pulmonary lesions in primary coccidioidomycosis. Am J Roentgenol 1944; 51:1.
Willett FM, Weiss A. Coccidioidomycosis in Southern California; report of a new endemic area with a review of 100 cases. Ann Intern Med 1945; 23:349.
SWEIGERT CF, TURNER JW, GILLESPIE JB. Clinical and roentgenologic aspects of coccidioidomycosis. Am J Med Sci 1946; 212:652.
TAYLOR AB, BRINEY AK. Observations on primary coccidioidomycosis. Ann Intern Med 1949; 30:1224.
From the Centers for Disease Control. Coccidiodomycosis in travelers returning for Mexico–Pennsylvania, 2000. JAMA 2000; 284:2990.
Chaturvedi V, Ramani R, Gromadzki S, et al. Coccidioidomycosis in New York State. Emerg Infect Dis 2000; 6:25.
Kim MM, Blair JE, Carey EJ, et al. Coccidioidal pneumonia, Phoenix, Arizona, USA, 2000-2004. Emerg Infect Dis 2009; 15:397.
Campion JM, Gardner M, Galgiani JN . Coccidioidomycosis (valley Fever) in older adults: An increasing problem. Arizona Geriatr Soc J 2003; 8:3.
Chang DC, Anderson S, Wannemuehler K, et al. Testing for coccidioidomycosis among patients with community-acquired pneumonia. Emerg Infect Dis 2008; 14:1053.
Pappagianis D, Zimmer BL. Serology of coccidioidomycosis. Clin Microbiol Rev 1990; 3:247.
Galgiani JN. Coccidioidomycosis. West J Med 1993; 159:153.
Stevens DA. Coccidioidomycosis. N Engl J Med 1995; 332:1077.
Drutz DJ, Catanzaro A. Coccidioidomycosis. Part II. Am Rev Respir Dis 1978; 117:727.
Patterson TF, Thompson GR 3rd, Denning DW, et al. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis 2016; 63:e1.
Patterson R, Greenberger PA, Halwig JM, et al. Allergic bronchopulmonary aspergillosis. Natural history and classification of early disease by serologic and roentgenographic studies. Arch Intern Med 1986; 146:916.
Agarwal R, Gupta D, Aggarwal AN, et al. Allergic bronchopulmonary aspergillosis: lessons from 126 patients attending a chest clinic in north India. Chest 2006; 130:442.
Natarajan S, Subramanian P. Allergic bronchopulmonary aspergillosis: A clinical review of 24 patients: Are we right in frequent serologic monitoring? Ann Thorac Med 2014; 9:216.
Wark PA, Gibson PG, Wilson AJ. Azoles for allergic bronchopulmonary aspergillosis associated with asthma. Cochrane Database Syst Rev 2004; :CD001108.
De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008; 46:1813.
Herbrecht R, Patterson TF, Slavin MA, et al. Application of the 2008 definitions for invasive fungal diseases to the trial comparing voriconazole versus amphotericin B for therapy of invasive aspergillosis: a collaborative study of the Mycoses Study Group (MSG 05) and the European Organization for Research and Treatment of Cancer Infectious Diseases Group. Clin Infect Dis 2015; 60:713.
Diekema DJ, Messer SA, Hollis RJ, et al. Activities of caspofungin, itraconazole, posaconazole, ravuconazole, voriconazole, and amphotericin B against 448 recent clinical isolates of filamentous fungi. J Clin Microbiol 2003; 41:3623.
Roden MM, Zaoutis TE, Buchanan WL, et al. Epidemiology and outcome of zygomycosis: a review of 929 reported cases. Clin Infect Dis 2005; 41:634.
GALE GR, WELCH AM. Studies of opportunistic fungi. I. Inhibition of Rhizopus oryzae by human serum. Am J Med Sci 1961; 241:604.
Ferguson BJ. Mucormycosis of the nose and paranasal sinuses. Otolaryngol Clin North Am 2000; 33:349.
Greenberg RN, Scott LJ, Vaughn HH, Ribes JA. Zygomycosis (mucormycosis): emerging clinical importance and new treatments. Curr Opin Infect Dis 2004; 17:517.
Kontoyiannis DP, Lionakis MS, Lewis RE, et al. Zygomycosis in a tertiary-care cancer center in the era of Aspergillus-active antifungal therapy: a case-control observational study of 27 recent cases. J Infect Dis 2005; 191:1350.
Kontoyiannis DP. Decrease in the number of reported cases of zygomycosis among patients with diabetes mellitus: a hypothesis. Clin Infect Dis 2007; 44:1089.
Petrikkos G, Skiada A, Lortholary O, et al. Epidemiology and clinical manifestations of mucormycosis. Clin Infect Dis 2012; 54 Suppl 1:S23.
Radner AB, Witt MD, Edwards JE Jr. Acute invasive rhinocerebral zygomycosis in an otherwise healthy patient: case report and review. Clin Infect Dis 1995; 20:163.
Del Valle Zapico A, Rubio Suárez A, Mellado Encinas P, et al. Mucormycosis of the sphenoid sinus in an otherwise healthy patient. Case report and literature review. J Laryngol Otol 1996; 110:471.
Elinav H, Zimhony O, Cohen MJ, et al. Rhinocerebral mucormycosis in patients without predisposing medical conditions: a review of the literature. Clin Microbiol Infect 2009; 15:693.
Rajagopalan S. Serious infections in elderly patients with diabetes mellitus. Clin Infect Dis 2005; 40:990.
Shields JA, Shields CL. Eyelid, Conjunctival, and Orbital Tumors: An Atlas and Textbook, 3rd ed, Lippincott Williams & Wilkins, Philadelphia 2016.
Legouge C, Caillot D, Chrétien ML, et al. The reversed halo sign: pathognomonic pattern of pulmonary mucormycosis in leukemic patients with neutropenia? Clin Infect Dis 2014; 58:672.
McCarthy M, Rosengart A, Schuetz AN, et al. Mold infections of the central nervous system. N Engl J Med 2014; 371:150.
Gonzalez CE, Couriel DR, Walsh TJ. Disseminated zygomycosis in a neutropenic patient: successful treatment with amphotericin B lipid complex and granulocyte colony-stimulating factor. Clin Infect Dis 1997; 24:192.
Chamilos G, Lewis RE, Kontoyiannis DP. Delaying amphotericin B-based frontline therapy significantly increases mortality among patients with hematologic malignancy who have zygomycosis. Clin Infect Dis 2008; 47:503.
Mirza SA, Phelan M, Rimland D, et al. The changing epidemiology of cryptococcosis: an update from population-based active surveillance in 2 large metropolitan areas, 1992-2000. Clin Infect Dis 2003; 36:789.
Rajasingham R, Smith RM, Park BJ, et al. Global burden of disease of HIV-associated cryptococcal meningitis: an updated analysis. Lancet Infect Dis 2017; 17:873.
Jarvis JN, Harrison TS. HIV-associated cryptococcal meningitis. AIDS 2007; 21:2119.
Tenforde MW, Mokomane M, Leeme T, et al. Advanced Human Immunodeficiency Virus Disease in Botswana Following Successful Antiretroviral Therapy Rollout: Incidence of and Temporal Trends in Cryptococcal Meningitis. Clin Infect Dis 2017; 65:779.
Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in HIV-infected adults and adolescents: Recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America.
Jarvis JN, Percival A, Bauman S, et al. Evaluation of a novel point-of-care cryptococcal antigen test on serum, plasma, and urine from patients with HIV-associated cryptococcal meningitis. Clin Infect Dis 2011; 53:1019.
Boulware DR, Rolfes MA, Rajasingham R, et al. Multisite validation of cryptococcal antigen lateral flow assay and quantification by laser thermal contrast. Emerg Infect Dis 2014; 20:45.
Tanner DC, Weinstein MP, Fedorciw B, et al. Comparison of commercial kits for detection of cryptococcal antigen. J Clin Microbiol 1994; 32:1680.
Chanock SJ, Toltzis P, Wilson C. Cross-reactivity between Stomatococcus mucilaginosus and latex agglutination for cryptococcal antigen. Lancet 1993; 342:1119.
Rhein J, Bahr NC, Hemmert AC, et al. Diagnostic performance of a multiplex PCR assay for meningitis in an HIV-infected population in Uganda. Diagn Microbiol Infect Dis 2016; 84:268.
Leber AL, Everhart K, Balada-Llasat JM, et al. Multicenter Evaluation of BioFire FilmArray Meningitis/Encephalitis Panel for Detection of Bacteria, Viruses, and Yeast in Cerebrospinal Fluid Specimens. J Clin Microbiol 2016; 54:2251.
Larsen RA, Bozzette S, McCutchan JA, et al. Persistent Cryptococcus neoformans infection of the prostate after successful treatment of meningitis. California Collaborative Treatment Group. Ann Intern Med 1989; 111:125.
The World Health Organization. Guidelines for the diagnosis, prevention and management of cryptococcal disease in HIV-infected adults, adolescents, and children.
Brouwer AE, Rajanuwong A, Chierakul W, et al. Combination antifungal therapies for HIV-associated cryptococcal meningitis: a randomised trial. Lancet 2004; 363:1764.
Milefchik E, Leal MA, Haubrich R, et al. Fluconazole alone or combined with flucytosine for the treatment of AIDS-associated cryptococcal meningitis. Med Mycol 2008; 46:393.
Dromer F, Bernede-Bauduin C, Guillemot D, et al. Major role for amphotericin B-flucytosine combination in severe cryptococcosis. PLoS One 2008; 3:e2870.
Molloy SF, Kanyama C, Heyderman RS, et al. Antifungal Combinations for Treatment of Cryptococcal Meningitis in Africa. N Engl J Med 2018; 378:1004.
Tenforde MW, Shapiro AE, Rouse B, et al. Treatment for HIV-associated cryptococcal meningitis. Cochrane Database Syst Rev 2018; 7:CD005647.





