Fístula Traqueoesofágica y Atresia Esofágica: Diagnóstico y Tratamiento.
La fístula traqueoesofágica es una malformación congénita común del tracto respiratorio, con una incidencia de aproximadamente 1 en 3500 a 1 en 4500 nacidos vivos. La fístula traqueoesofágica ocurre típicamente aunada a atresia esofágica. Revisamos a continuación las claves del diagnóstico y tratamiento de estas dos entidades de la gastroenterología pediátrica.
La fístula traqueoesofágica y atresia esofágica se clasifican según su configuración anatómica. El tipo C, que consiste en una bolsa esofágica proximal y un fístula traqueoesofágica distal, representa el 84% de los casos. La fístula traqueoesofágica ocurre sin atresia esofágica (fístula tipo H) en solo el 4% de los casos. También se han reportado otras variaciones raras. La clasificación de Ladd es la más aceptada, que distingue los cinco tipos siguientes:
- Tipo I: atresia sin fístula.
- Tipo II: fístula proximal y atresia distal.
- Tipo III: atresia proximal y fístula distal.
- Tipo IV: doble fístula.
- Tipo V: fístula sin atresia.
La forma más frecuente (casi el 84% de los casos) corresponde al tipo III o C. La fístula traqueoesofágica y la atresia esofágica están causadas por un defecto en el septum lateral del primordio intestinal del esófago y la tráquea. Se cree que el tracto de la fístula se deriva de una rama del saco embrionario del pulmón que no se ramifica debido a interacciones epiteliales mesenquimales defectuosas. En aproximadamente la mitad de los casos de fístula traqueoesofágica y atresia esofágica existen anomalías asociadas, a menudo como parte de las asociaciones VACTERL o CHARGE, y especialmente con defectos congénitos del corazón o genitourinarios.
Presentación Clínica
La presentación clínica de la fístula traqueoesofágica depende de la presencia o ausencia de atresia esofágica. En los casos con atresia esofágica (95%), el polihidramnios ocurre en aproximadamente dos tercios de los embarazos. Sin embargo, muchos casos no se detectan prenatalmente. Las características clínicas adicionales se relacionan con la presencia de la asociación VACTERL. Los bebés con atresia esofágica se vuelven sintomáticos inmediatamente después del nacimiento con secreciones excesivas que causan babeo, asfixia, dificultad respiratoria y la incapacidad para alimentarse. Una fístula entre la tráquea y el esófago distal conduce a distensión gástrica. El reflujo de los contenidos gástricos a través de la fístula traqueoesofágica produce neumonía por aspiración y contribuye a la morbilidad.
Los pacientes con fístula traqueoesofágica de tipo H pueden debutar de manera temprana si el defecto es grande, con tos y atragantamiento asociados con la alimentación a medida que se aspira la leche a través de la fístula. Sin embargo, los defectos más pequeños de este tipo pueden no ser sintomáticos en el período neonatal. En una serie, el retraso en el diagnóstico varió de 26 días a 4 años. Estos pacientes suelen tener antecedente de larga evolución de dificultad respiratoria leve asociada a la alimentación o episodios recurrentes de neumonía. En ocasiones, el diagnóstico puede demorarse por períodos más largos e incluso hasta la edad adulta.
Diagnóstico
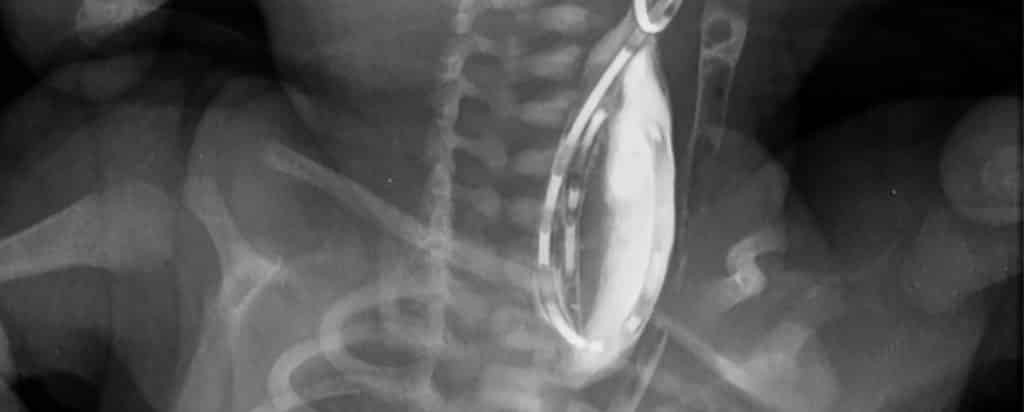
El diagnóstico de atresia esofágica se puede hacer al intentar pasar un catéter hacia el estómago. En los bebés afectados, el catéter no se puede pasar más allá de aproximadamente 10 a 15 cm. Este hallazgo se puede confirmar mediante una radiografía de tórax anteroposterior que muestra el catéter rizado en la bolsa superior del esófago. En la radiografía de tórax lateral se puede observar un fístula traqueoesofágica distal. Ambas vistas revelarán un tracto gastrointestinal lleno de aire. Cuando el diagnóstico es incierto o se sospecha una fístula traqueoesofágica proximal, se puede pasar una pequeña cantidad de contraste hidrosoluble en la bolsa esofágica bajo guía fluoroscópica para confirmar la presencia de atresia esofágica.

No se debe usar bario como agente de contraste porque causa neumonitis si se aspira a los pulmones. El material de contraste debe eliminarse inmediatamente para evitar la regurgitación y la aspiración. El diagnóstico de fístula traqueoesofágica aislada es más complicada. La demostración de la fístula debe intentarse con una serie gastroduodenal utilizando material de contraste espeso hidrosoluble. El método tradicional requiere una técnica de extracción en la cual primero se llena el esófago distal y luego el catéter se retira en dirección cefálica. Estudios posteriores han sugerido una sensibilidad diagnóstica igual o mejor con la radiografía de contraste. Sin embargo, el tracto fistuloso puede perderse en estos estudios.
En estos últimos casos, se debe utilizar la endoscopia esofágica y la broncoscopia para detectar la fístula traqueoesofágica. La demostración de la fístula se puede lograr mediante la aparición en el esófago de una pequeña cantidad de azul de metileno que se inyecta en la tráquea. El uso de la tomografía computarizada tridimensional también se ha recomendado como un método adicional para el diagnóstico de la fístula traqueoesofágica.
Manejo Inicial
El tratamiento consiste en la ligadura quirúrgica de la fístula. En la fístula traqueoesofágica aislada, se puede usar un abordaje cervical en la mayoría de los casos. En los casos con atresia esofágica, se prefiere la anastomosis primaria de los segmentos esofágicos. Los avances en el manejo médico de estos bebés combinados con las nuevas técnicas quirúrgicas han mejorado los resultados. La reparación primaria puede no ser posible si la distancia entre los segmentos esofágicos es grande. En ese caso, se han realizado procedimientos diferidos que incluyen el alargamiento del esófago, la interposición del yeyuno o el colon y la transposición gástrica. En lactantes de muy bajo peso al nacer, este enfoque por etapas se ha asociado a mejores resultados.
Debido a que el reflujo gastroesofágico es común, un panel de expertos recomendó que los bebés con fístula traqueoesofágica reparada se traten de manera rutinaria con un inhibidor de bomba de protones durante al menos un año después de la reparación, y por más tiempo para aquellos con evidencia de reflujo gastroesofágico. Esta estrategia se basa en la opinión de expertos, con evidencia limitada. Los bebés con fístula traqueoesofágica tienen un mayor riesgo de dificultades con la alimentación y pueden beneficiarse de la consulta con un especialista en alimentación para evitar un trastorno crónico.
Tanto las anormalidades pulmonares como las gastrointestinales pueden persistir durante la edad adulta. El reflujo gastroesofágico persiste en la mayoría de los pacientes y una complicación a largo plazo de esto es el esófago de Barrett. Como resultado, el panel recomendó que los niños con fístula traqueoesofágica reparada sean monitoreados longitudinalmente para detectar problemas pulmonares y gastrointestinales durante la infancia.
Complicaciones de la Fístula Traqueoesofágica y Atresia Esofágica
El pronóstico para la fístula traqueoesofágica aislada es generalmente bueno. El pronóstico de los bebés con atresia esofágica y fístula traqueoesofágica es reservado y depende de las anomalías asociadas. En un informe, el 87% de los pacientes con atresia esofágica o atresia esofágica y fístula traqueoesofágica (1980 a 1997) sobrevivieron. El 61% de las muertes tempranas se asoció con anomalías cardíacas y cromosómicas. Las tasas de mortalidad por atresia esofágica y fístula traqueoesofágica fueron mayores en los bebés con enfermedad cardíaca asociada (42 versus 12% sin ella). El bajo peso al nacer no fue un factor de riesgo relevante.
Una revisión informó tasas de supervivencia significativamente más altas para los lactantes con y sin anomalías congénitas asociadas. En esta serie, el peso al nacer fue un factor en la supervivencia. La longitud del segmento ausente en la atresia esofágica (la distancia entre las dos bolsas esofágicas) también puede determinar el pronóstico. Las complicaciones después de la reparación de la atresia esofágica y fístula traqueoesofágica en una serie de 227 casos incluyeron fuga anastomótica (16%), estenosis esofágica (35%) y fístulas recurrentes (3%). La estenosis esofágica se ha manejado con éxito mediante dilatación endoscópica con balón. La traqueomalacia ocurrió en el 15% de los casos y el 40% de estos requirió reparación quirúrgica.
La peristalsis anormal y el retraso del vaciamiento gástrico son comunes y contribuyen al reflujo gastroesofágico y la aspiración. Los trastornos de la motilidad y las anomalías de la función respiratoria son comunes después de la reparación de la atresia esofágica y fístula traqueoesofágica, y requieren supervisión. En muchos casos, estos problemas persisten en el seguimiento a largo plazo. Una revisión sistemática de los resultados a largo plazo en la edad adulta después de la reparación de la atresia esofágica durante la infancia informó las siguientes prevalencias estimadas agrupadas:
- Disfagia 50.3%
- Enfermedad por reflujo gastroesofágico (ERGE) con esofagitis 40,2%
- ERGE sin esofagitis 56.5%
- Infecciones del tracto respiratorio 24.1%
- Asma (diagnosticado por un médico) 22.3%
- Sibilancias 34.7%
- Tos persistente 14.6%
- Esófago de Barrett – 6.4%
- Cáncer de esófago (de células escamosas) 1.4%
La prevalencia de esófago de Barrett en la edad adulta fue cuatro veces mayor que la de la población general, y es un factor de riesgo conocido para el cáncer de esófago. El riesgo de cáncer esofágico es aproximadamente 50 veces mayor que en la población general mayor de 40 años, y se encontró un riesgo similar en una serie de casos por separado. El riesgo para el esófago de Barrett es mayor entre los pacientes con síntomas de reflujo y pacientes masculinos mayores de 35 años, pero esta lesión se ha encontrado ocasionalmente en aquellos sin estos factores de riesgo. El enfoque óptimo para la detección y la vigilancia no se ha establecido.
Manejo a Largo Plazo
Tanto las anormalidades pulmonares como las gastrointestinales pueden persistir durante la edad adulta. El manejo a largo plazo se centra en la detección temprana y el manejo agresivo de estas complicaciones comunes, guiado idealmente por un equipo multidisciplinario con cirujanos, así como especialistas en neumología pediátrica, gastroenterología y otorrinolaringología. Un panel de expertos ha realizado recomendaciones específicas, basadas principalmente en la opinión de expertos con evidencia clínica limitada:
- Todos los niños y adultos deben ser monitoreados rutinariamente para detectar síntomas de ERGE, disfagia y aspiración. Estas patologías tienen síntomas similares o superpuestos, especialmente en niños pequeños.
- Todos los pacientes deben someterse a al menos tres endoscopias de vigilancia durante la infancia para detectar la esofagitis temprana. La vigilancia endoscópica de rutina debe continuarse en la edad adulta, cada 5 a 10 años.
- Los pacientes con síntomas de ERGE o disfagia deben evaluarse con un estudio de contraste esofágico y una endoscopia. La esofagitis se debe tratar de forma agresiva con IBPs y las estenosis esofágicas con dilatación e IBPs. Los pacientes asintomáticos no requieren detección de rutina o dilatación para las estenosis.
- Los pacientes con síntomas respiratorios deben ser evaluados cuidadosamente para detectar anomalías anatómicas, como estenosis anastomótica, hendidura laríngea, parálisis de las cuerdas vocales, estenosis esofágica congénita, fístula recurrente o malformaciones vasculares congénitas. La supresión ácida sola probablemente no mejore los síntomas respiratorios y en realidad puede predisponer a la infección respiratoria.
- La fundoplicatura tiene un papel limitado en los pacientes con fístula traqueoesofágica porque la dismotilidad esofágica subyacente predispone a las complicaciones posteriores a la funduplicatura (p. Ej., estasis esofágica y posiblemente a la aspiración). Sin embargo, se puede considerar la fundoplicatura en pacientes seleccionados, como aquellos con ERGE mal controlado a pesar de la terapia máxima con IBPs, la dependencia a largo plazo de la alimentación transpilórica o los episodios cianóticos debidos a ERGE. La esofagitis eosinofílica debe descartarse antes de proceder a la fundoplicatura.
Todos los pacientes y sus familias deben recibir información sobre estos riesgos y la importancia de la vigilancia clínica y endoscópica, y estos problemas clínicos deben incorporarse en una transición bien organizada a la atención por parte de un gastroenterólogo.
Referencias Bibliográficas
Clark DC. Esophageal atresia and tracheoesophageal fistula. Am Fam Physician 1999; 59:910.
LaSalle AJ, Andrassy RJ, Ver Steeg K, Ratner I. Congenital tracheoesophageal fistula without esophageal atresia. J Thorac Cardiovasc Surg 1979; 78:583.
Kane TD, Atri P, Potoka DA. Triple fistula: management of a double tracheoesophageal fistula with a third H-type proximal fistula. J Pediatr Surg 2007; 42:E1.
Katsura S, Shono T, Yamanouchi T, et al. Esophageal atresia with double tracheoesophageal fistula–a case report and review of the literature. Eur J Pediatr Surg 2005; 15:354.
Crisera CA, Grau JB, Maldonado TS, et al. Defective epithelial-mesenchymal interactions dictate the organogenesis of tracheoesophageal fistula. Pediatr Surg Int 2000; 16:256.
Goyal A, Jones MO, Couriel JM, Losty PD. Oesophageal atresia and tracheo-oesophageal fistula. Arch Dis Child Fetal Neonatal Ed 2006; 91:F381.
Shaw-Smith C. Oesophageal atresia, tracheo-oesophageal fistula, and the VACTERL association: Review of genetics and epidemiology. J Med Genet 2006; 43:545.
Bednarczyk D, Sasiadek MM, Smigiel R. Chromosome aberrations and gene mutations in patients with esophageal atresia. J Pediatr Gastroenterol Nutr 2013; 57:688.
Lautz TB, Mandelia A, Radhakrishnan J. VACTERL associations in children undergoing surgery for esophageal atresia and anorectal malformations: Implications for pediatric surgeons. J Pediatr Surg 2015; 50:1245.
Pretorius DH, Drose JA, Dennis MA, et al. Tracheoesophageal fistula in utero. Twenty-two cases. J Ultrasound Med 1987; 6:509.
Sparey C, Jawaheer G, Barrett AM, Robson SC. Esophageal atresia in the Northern Region Congenital Anomaly Survey, 1985-1997: prenatal diagnosis and outcome. Am J Obstet Gynecol 2000; 182:427.
Karnak I, Senocak ME, Hiçsönmez A, Büyükpamukçu N. The diagnosis and treatment of H-type tracheoesophageal fistula. J Pediatr Surg 1997; 32:1670.
Zacharias J, Genc O, Goldstraw P. Congenital tracheoesophageal fistulas presenting in adults: presentation of two cases and a synopsis of the literature. J Thorac Cardiovasc Surg 2004; 128:316.
Laffan EE, Daneman A, Ein SH, et al. Tracheoesophageal fistula without esophageal atresia: are pull-back tube esophagograms needed for diagnosis? Pediatr Radiol 2006; 36:1141.
Nagata K, Kamio Y, Ichikawa T, et al. Congenital tracheoesophageal fistula successfully diagnosed by CT esophagography. World J Gastroenterol 2006; 12:1476.
Islam S, Cavanaugh E, Honeke R, Hirschl RB. Diagnosis of a proximal tracheoesophageal fistula using three-dimensional CT scan: a case report. J Pediatr Surg 2004; 39:100.
Dogan BE, Fitoz S, Atasoy C, et al. Tracheoesophageal fistula: demonstration of recurrence by three-dimensional computed tomography. Curr Probl Diagn Radiol 2005; 34:167.
Ko BA, Frederic R, DiTirro PA, et al. Simplified access for division of the low cervical/high thoracic H-type tracheoesophageal fistula. J Pediatr Surg 2000; 35:1621.
Little DC, Rescorla FJ, Grosfeld JL, et al. Long-term analysis of children with esophageal atresia and tracheoesophageal fistula. J Pediatr Surg 2003; 38:852.
Orford J, Cass DT, Glasson MJ. Advances in the treatment of oesophageal atresia over three decades: the 1970s and the 1990s. Pediatr Surg Int 2004; 20:402.
Tsao K, Lee H. Extrapleural thoracoscopic repair of esophageal atresia with tracheoesophageal fistula. Pediatr Surg Int 2005; 21:308.
Krosnar S, Baxter A. Thoracoscopic repair of esophageal atresia with tracheoesophageal fistula: anesthetic and intensive care management of a series of eight neonates. Paediatr Anaesth 2005; 15:541.
Rothenberg SS. Thoracoscopic repair of esophageal atresia and tracheo-esophageal fistula. Semin Pediatr Surg 2005; 14:2.
Meier JD, Sulman CG, Almond PS, Holinger LD. Endoscopic management of recurrent congenital tracheoesophageal fistula: a review of techniques and results. Int J Pediatr Otorhinolaryngol 2007; 71:691.
Holcomb GW 3rd, Rothenberg SS, Bax KM, et al. Thoracoscopic repair of esophageal atresia and tracheoesophageal fistula: a multi-institutional analysis. Ann Surg 2005; 242:422.
Freire JP, Feijó SM, Miranda L, et al. Tracheo-esophageal fistula: combined surgical and endoscopic approach. Dis Esophagus 2006; 19:36.
Patkowsk D, Rysiakiewicz K, Jaworski W, et al. Thoracoscopic repair of tracheoesophageal fistula and esophageal atresia. J Laparoendosc Adv Surg Tech A 2009; 19 Suppl 1:S19.
Varjavandi V, Shi E. Early primary repair of long gap esophageal atresia: the VATER operation. J Pediatr Surg 2000; 35:1830.
Spitz L. Oesophageal atresia treatment: a 21st-century perspective. J Pediatr Gastroenterol Nutr 2011; 52 Suppl 1:S12.
van der Zee DC. Thoracoscopic elongation of the esophagus in long-gap esophageal atresia. J Pediatr Gastroenterol Nutr 2011; 52 Suppl 1:S13.
Bairdain S, Foker JE, Smithers CJ, et al. Jejunal Interposition after Failed Esophageal Atresia Repair. J Am Coll Surg 2016; 222:1001.
Petrosyan M, Estrada J, Hunter C, et al. Esophageal atresia/tracheoesophageal fistula in very low-birth-weight neonates: improved outcomes with staged repair. J Pediatr Surg 2009; 44:2278.
Krishnan U, Mousa H, Dall’Oglio L, et al. ESPGHAN-NASPGHAN Guidelines for the Evaluation and Treatment of Gastrointestinal and Nutritional Complications in Children With Esophageal Atresia-Tracheoesophageal Fistula. J Pediatr Gastroenterol Nutr 2016; 63:550.
Teich S, Barton DP, Ginn-Pease ME, King DR. Prognostic classification for esophageal atresia and tracheoesophageal fistula: Waterston versus Montreal. J Pediatr Surg 1997; 32:1075.
Choudhury SR, Ashcraft KW, Sharp RJ, et al. Survival of patients with esophageal atresia: influence of birth weight, cardiac anomaly, and late respiratory complications. J Pediatr Surg 1999; 34:70.
Konkin DE, O’hali WA, Webber EM, Blair GK. Outcomes in esophageal atresia and tracheoesophageal fistula. J Pediatr Surg 2003; 38:1726.
Upadhyaya VD, Gangopadhyaya AN, Gupta DK, et al. Prognosis of congenital tracheoesophageal fistula with esophageal atresia on the basis of gap length. Pediatr Surg Int 2007; 23:767.
Engum SA, Grosfeld JL, West KW, et al. Analysis of morbidity and mortality in 227 cases of esophageal atresia and/or tracheoesophageal fistula over two decades. Arch Surg 1995; 130:502.
Antoniou D, Soutis M, Christopoulos-Geroulanos G. Anastomotic strictures following esophageal atresia repair: a 20-year experience with endoscopic balloon dilatation. J Pediatr Gastroenterol Nutr 2010; 51:464.
Michaud L, Gottrand F. Anastomotic strictures: conservative treatment. J Pediatr Gastroenterol Nutr 2011; 52 Suppl 1:S18.
de Lagausie P. GER in oesophageal atresia: surgical options. J Pediatr Gastroenterol Nutr 2011; 52 Suppl 1:S27.
Yanchar NL, Gordon R, Cooper M, et al. Significance of the clinical course and early upper gastrointestinal studies in predicting complications associated with repair of esophageal atresia. J Pediatr Surg 2001; 36:815.
Romeo C, Bonanno N, Baldari S, et al. Gastric motility disorders in patients operated on for esophageal atresia and tracheoesophageal fistula: long-term evaluation. J Pediatr Surg 2000; 35:740.
Legrand C, Michaud L, Salleron J, et al. Long-term outcome of children with oesophageal atresia type III. Arch Dis Child 2012; 97:808.
Robertson DF, Mobaireek K, Davis GM, Coates AL. Late pulmonary function following repair of tracheoesophageal fistula or esophageal atresia. Pediatr Pulmonol 1995; 20:21.
Gischler SJ, van der Cammen-van Zijp MH, Mazer P, et al. A prospective comparative evaluation of persistent respiratory morbidity in esophageal atresia and congenital diaphragmatic hernia survivors. J Pediatr Surg 2009; 44:1683.
Delacourt C, de Blic J. Pulmonary outcome of esophageal atresia. J Pediatr Gastroenterol Nutr 2011; 52 Suppl 1:S31.
Beucher J, Wagnon J, Daniel V, et al. Long-term evaluation of respiratory status after esophageal atresia repair. Pediatr Pulmonol 2013; 48:188.
Taylor AC, Breen KJ, Auldist A, et al. Gastroesophageal reflux and related pathology in adults who were born with esophageal atresia: a long-term follow-up study. Clin Gastroenterol Hepatol 2007; 5:702.
Tomaselli V, Volpi ML, Dell’Agnola CA, et al. Long-term evaluation of esophageal function in patients treated at birth for esophageal atresia. Pediatr Surg Int 2003; 19:40.
Kovesi T, Rubin S. Long-term complications of congenital esophageal atresia and/or tracheoesophageal fistula. Chest 2004; 126:915.
Nasr A, Ein SH, Gerstle JT. Infants with repaired esophageal atresia and distal tracheoesophageal fistula with severe respiratory distress: is it tracheomalacia, reflux, or both? J Pediatr Surg 2005; 40:901.
Rintala RJ, Sistonen S, Pakarinen MP. Outcome of oesophageal atresia beyond childhood. J Pediatr Gastroenterol Nutr 2011; 52 Suppl 1:S35.
Coppens CH, van den Engel-Hoek L, Scharbatke H, et al. Dysphagia in children with repaired oesophageal atresia. Eur J Pediatr 2016; 175:1209.
Gibreel W, Zendejas B, Antiel RM, et al. Swallowing Dysfunction and Quality of Life in Adults With Surgically Corrected Esophageal Atresia/Tracheoesophageal Fistula as Infants: Forty Years of Follow-up. Ann Surg 2017; 266:305.
Connor MJ, Springford LR, Kapetanakis VV, Giuliani S. Esophageal atresia and transitional care–step 1: a systematic review and meta-analysis of the literature to define the prevalence of chronic long-term problems. Am J Surg 2015; 209:747.
Jayasekera CS, Desmond PV, Holmes JA, et al. Cluster of 4 cases of esophageal squamous cell cancer developing in adults with surgically corrected esophageal atresia–time for screening to start. J Pediatr Surg 2012; 47:646.
DeBoer EM, Prager JD, Ruiz AG, et al. Multidisciplinary care of children with repaired esophageal atresia and tracheoesophageal fistula. Pediatr Pulmonol 2016; 51:576.





