Pubertad, Pubertad Precoz y Retraso de la Pubertad.

La pubertad comprende el periodo de vida de maduración sexual, desarrollo de caracteres sexuales secundarios y de la talla adulta. En la siguiente revisión abordamos la pubertad fisiológica, diagnóstico y tratamiento de la pubertad precoz, así como del retraso de la pubertad.
La pubertad fisiológica ocurre en varones de los 9 a 14 años de edad, mientras que en las niñas ocurre entre los 8 y 13 años. Cuando ocurre antes o después de dicha edad, se determina como pubertad precoz o retraso de la pubertad, respectivamente.
Estadios de Tanner
Para la evaluación del paciente se hace uso de los estadios de Tanner, existiendo una clasificación para mujeres y otra para hombres.
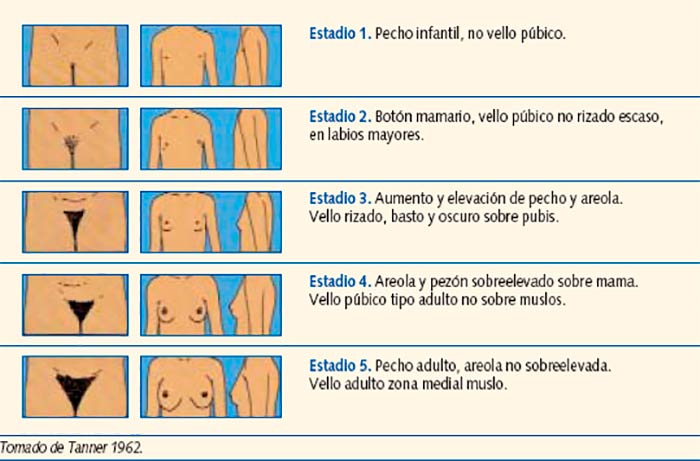
Escala de Tanner en Mujeres. 
Escala de Tanner en Varones.
En mujeres, el desarrollo sexual comienza con la aparición del botón mamario, seguido de la pubarquia y axilarquia. Se alcanza el nivel máximo de desarrollo sexual entre los estadios II y III de Tanner. Por último, la menarquia ocurre 18 a 24 meses posterior al inicio del desarrollo mamario, coincidiendo con el estadio IV de Tanner. Los ciclos menstruales durante los primeros 12 a 18 meses posterior a la menarquia no forman cuerpo lúteo, son erráticos y anovulatorios.
En varones, el primer signo del comienzo del desarrollo sexual es el crecimiento del volumen testicular a más de 4 ml., seguido del crecimiento del pene, pubarquia, axilarquia, cambio de voz y vello facial. El punto máximo de desarrollo sexual ocurre en los estadios III y IV de Tanner. La aparición de espermatozoides en la orina y el inicio de las emisiones nocturnas de espermatozoides ocurren poco después de alcanzar la velocidad máxima de crecimiento. Muchos consideran estos eventos el equivalente masculino de la menarquia.
Durante la pubertad aumenta la sensibilidad a la GnRH y comienza la secreción pulsátil de LH a nivel adenohipofisiario. Ello ocurre inicialmente durante el sueño y posteriormente durante el día, de tal manera que la respuesta de la LH a la GnRH es mayor que a la FSH. Ello permite la maduración sexual.
Pubertad Precoz
Ocurre cuando los signos de desarrollo sexual secundario aparecen antes de los 8 años en niñas y 9 años en niños. La pubertad precoz se clasifica, dependiendo de su etiopatogenia, en dependiente o independiente de gonadotropinas. Existen además variantes de la pubertad fisiológica.
Pubertad precoz dependiente de gonadotropinas
Se denomina también pubertad precoz central o verdadera. Es mucho más frecuente en niñas que en niños, con una relación 23:1. Los pacientes tienen una velocidad de crecimiento acelerada, edad ósea adelantada a la cronológica y niveles puberales de gonadotropinas y esteroides sexuales. La pubertad precoz central es patológica en el 40 a 70% de los casos en niños, y el 10 a 20% de las niñas.
Los hamartomas del tuber cinereum son el tumor más frecuente productor de pubertad precoz central; otros tumores relacionados son los astrocitomas, ependimomas, tumores pineales y gliomas del nervio óptico. Otras situaciones y entidades que pueden relacionarse son la irradiación del SNC, la hidrocefalia, traumatismos, infecciones, el hipotiroidismo, sensibilización por esteroides exógenos, hiperplasia suprarrenal congénita o el síndrome de McCune-Albright.
Las etapas del desarrollo sexual se presentan en el orden normal y son apropiadas al género del niño (isosexual); sin embargo, aparecen antes de tiempo. Existe un pico de LH al estímulo con GnRH. Esta variante es sensible al tratamiento con análogos de GnRH (ver más abajo).
Pubertad precoz independiente de gonadotropinas
Se conoce como pubertad precoz periférica o pseudopubertad precoz. La pubertad precoz periférica es causada por la secreción excesiva de hormonas sexuales gonadales o de las glándulas suprarrenales, por gonadotropina coriónica humana (hCG) ectópica de un tumor de células germinales, o por fuentes exógenas de esteroides sexuales, y es independiente de la GnRH.
Las etapas y ritmo del desarrollo sexual están alterados, pudiendo ser iso- o contrasexual dependiendo del esteroide sexual predominante, es decir, estrógenos o andrógenos. Existe una respuesta abolida de FSH y LH posterior al estímulo con GnRH, dado que es independiente del eje hipotálamo-hipófisis.
Variantes de la Pubertad Fisiológica
Estos casos se presentan en niñas con telarquia o pubarquia prematura aislada y se consideran variantes de la normalidad. A pesar de ello, requieren de vigilancia dado que en el 20% de los casos puede evolucionar a una pubertad precoz completa. La pubarquia precoz se asocia a posterior hiperinsulinismo e hiperandrogenismo, por lo que se requiere evaluación para descartar formas tardías de hiperplasia suprarrenal congénita o formas no clásicas.
Evaluación del Paciente con Pubertad Precoz
Durante la evaluación del paciente es importante recabar en la historia clínica información sobre el desarrollo puberal, la velocidad de crecimiento, factores de riesgo y focalidad neurológica. En la exploración física asegúrate de medir el peso, talla, calcular la velocidad de crecimiento, realizar una exploración neurológica, detección de manchas café con leche, así como determinar el estadio de Tanner.
Pruebas de Laboratorio
El primer paso es medir la hormona luteinizante basal (LH), la hormona folículo estimulante (FSH) y las concentraciones de estradiol o testosterona. Los resultados se utilizan para diferenciar entre pubertad precoz central y periférica, que luego guiará las pruebas adicionales. En la pubertad precoz central, los niveles basales de LH a menudo se elevan a aquellos encontrados en la pubertad (más de 0.2 a 0.3 mIU/mL).
Las concentraciones de LH en el rango prepuberal (es decir, <0.2 mIU/mL) son consistentes con pubertad precoz periférica o con una variante de la pubertad fisiológica, como la telarquia prematura aislada. Si el cuadro clínico es discordante con las pruebas iniciales, se puede realizar una prueba de estimulación de hormona liberadora de gonadotropina (GnRH).
Mediante esta última prueba podrás distinguir la pubertad precoz central de una variante fisiológica. Los niños con pubertad precoz central tienen un pico de LH a la estimulación de GnRH.
Estudios de Imagen
Las indicaciones para estudios de imagen dependen del tipo de pubertad precoz. Indica RM de cráneo a todos los varones con pubertad precoz central debido a la alta prevalencia de lesiones del sistema nervioso central (SNC) en este grupo. Lo mismo aplica para las niñas con pubertad precoz antes de los 6 años de edad. A los niños con pubertad precoz periférica solicita un ultrasonido testicular para evaluar la posibilidad de un tumor de células de Leydig.
En las niñas con pubertad precoz periférica está indicada una ecografía pélvica para ayudar a identificar la presencia de un quiste o tumor ovárico. En ambos sexos, la ecografía de las glándulas suprarrenales puede estar indicada si se sospecha una patología suprarrenal, y debe realizarse si existe sospecha de un tumor suprarrenal. Además de la determinación de la edad ósea, generalmente no se requieren estudios de imagen adicionales para los niños con variantes puberales benignas o no progresivas.
Tratamiento
El principal objetivo del tratamiento de la pubertad precoz central es permitir que un niño crezca a la altura normal del adulto. La decisión de tratar o no al paciente depende en gran medida de la edad de inicio de la pubertad precoz, el ritmo de maduración sexual y la altura estimada del adulto según lo determinado por el ritmo de desarrollo de la edad ósea. En general, es probable que el tratamiento sea de mayor beneficio para los niños más jóvenes, aquellos con una progresión puberal rápida y una altura pronosticada más corta.
Los niños con variantes de pubertad precoz lentamente progresivas no requieren tratamiento porque alcanzan su máximo potencial sin tratamiento. De estar indicado el tratamiento, se usan agonistas de la hormona liberadora de gonadotropina (GnRH). Para los niños con pubertad precoz central, entre más rápido se inicie el tratamiento mayor la probabilidad de que alcancen su crecimiento normal.
La elección del agonista de GnRH depende de la preferencia del paciente y del médico. Se puede indicar el leuprolide administrado por vía intramuscular, ya sea la preparación para uno o tres meses. Durante el tratamiento con un agonista de GnRH, los pacientes deben ser monitoreados periódicamente para evaluar el desarrollo puberal, la velocidad de crecimiento y la edad ósea para determinar si la dosis es adecuada.
Pubertad Precoz Periférica
El tratamiento para la pubertad precoz periférica está dirigido a eliminar o bloquear la producción y/o respuesta al exceso de esteroides sexuales. Estos pacientes no responden al tratamiento con agonistas de GnRH, a menos que hayan desarrollado una pubertad precoz central secundaria. La testotoxicosis se trata con acetato de ciproterona o ketoconazol.
Variantes de la Pubertad Fisiológica
Las variantes benignas de la pubertad fisiológica o no progresiva no requieren intervención. Sin embargo, la evaluación clínica periódica y el seguimiento son importantes para confirmar el diagnóstico porque algunos pacientes, con presentación inicial consistente con una variante benigna, evolucionan a un trastorno progresivo.
Retraso de la Pubertad
Ocurre ante la ausencia de signos puberales en el rango de edad promedio. Es decir, un volumen testicular menor a 4 ml. a los 14 años de edad; en la mujer ausencia de telarquia a los 13 años. La causa más frecuente de retraso de la pubertad es el retraso constitucional de crecimiento y desarrollo. Se considera una variante extrema de la normalidad con crecimiento enlentecido en los primeros años de vida y edad ósea retrasada; predomina en varones.
El hipogonadismo hipogonadotropo se presenta con niveles bajos de testosterona, LH y FSH. Un retraso en el desarrollo sexual después de los 18 años de edad es altamente sugerente de déficit de GnRH. Son múltiples las probables causas de hipogonadismo hipogonadotropo, tales como tumores, hipotiroidismo, síndrome de Prader-Willi, enfermedades crónicas, etc. La causa más frecuente es el déficit aislado de GnRH, asociado o no a anosmia.
En el hipogonadismo hipergonadotropo se presenta una insuficiencia gonadal primaria, ya sea adquirida o congénita, con niveles de LH y FSH altos y esteroides sexuales bajos. Dentro de los síndromes congénitos están el Klinefelter y síndrome de Turner, mientras que en las adquiridas destacan la castración quirúrgica, radioterapia y quimioterapia. En general, está indicada la terapia sustitutiva para el retraso de la pubertad, tomando en cuenta la talla y su estimación en etapa adulta.
Referencias Bibliográficas
Tanner J. Growth at Adolescence, Blackwell Scientific Publications, Oxford 1962.
Herman-Giddens ME, Slora EJ, Wasserman RC, et al. Secondary sexual characteristics and menses in young girls seen in office practice: a study from the Pediatric Research in Office Settings network. Pediatrics 1997; 99:505.
Biro FM, Greenspan LC, Galvez MP, et al. Onset of breast development in a longitudinal cohort. Pediatrics 2013; 132:1019.
Sun SS, Schubert CM, Chumlea WC, et al. National estimates of the timing of sexual maturation and racial differences among US children. Pediatrics 2002; 110:911.
Herman-Giddens ME, Steffes J, Harris D, et al. Secondary sexual characteristics in boys: data from the Pediatric Research in Office Settings Network. Pediatrics 2012; 130:e1058.
Cutler GB Jr, Loriaux DL. Andrenarche and its relationship to the onset of puberty. Fed Proc 1980; 39:2384.
Marshall WA, Tanner JM. Variations in pattern of pubertal changes in girls. Arch Dis Child 1969; 44:291.
Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in boys. Arch Dis Child 1970; 45:13.
Zhu J, Choa RE, Guo MH, et al. A shared genetic basis for self-limited delayed puberty and idiopathic hypogonadotropic hypogonadism. J Clin Endocrinol Metab 2015; 100:E646.
Perry JR, Day F, Elks CE, et al. Parent-of-origin-specific allelic associations among 106 genomic loci for age at menarche. Nature 2014; 514:92.
Lunetta KL, Day FR, Sulem P, et al. Rare coding variants and X-linked loci associated with age at menarche. Nat Commun 2015; 6:7756.
Legro RS, Lin HM, Demers LM, Lloyd T. Rapid maturation of the reproductive axis during perimenarche independent of body composition. J Clin Endocrinol Metab 2000; 85:1021.
Apter D, Vihko R. Early menarche, a risk factor for breast cancer, indicates early onset of ovulatory cycles. J Clin Endocrinol Metab 1983; 57:82.
Pescovitz OH, Hench K, Green O, et al. Central precocious puberty complicating a virilizing adrenal tumor: treatment with a long-acting LHRH analog. J Pediatr 1985; 106:612.
Pescovitz OH, Cassorla F, Comite F, et al. LHRH analog treatment of central precocious puberty complicating congenital adrenal hyperplasia. Ann N Y Acad Sci 1985; 458:174.
Holland FJ, Kirsch SE, Selby R. Gonadotropin-independent precocious puberty (“testotoxicosis”): influence of maturational status on response to ketoconazole. J Clin Endocrinol Metab 1987; 64:328.
Faggiano M, Criscuolo T, Perrone L, et al. Sexual precocity in a boy due to hypersecretion of LH and prolactin by a pituitary adenoma. Acta Endocrinol (Copenh) 1983; 102:167.
Ambrosi B, Bassetti M, Ferrario R, et al. Precocious puberty in a boy with a PRL-, LH- and FSH-secreting pituitary tumour: hormonal and immunocytochemical studies. Acta Endocrinol (Copenh) 1990; 122:569.
Atay Z, Yesilkaya E, Erdeve SS, et al. The Etiology and Clinical Features of Non-CAH Gonadotropin-Independent Precocious Puberty: A Multicenter Study. J Clin Endocrinol Metab 2016; 101:1980.
Papanikolaou A, Michala L. Autonomous Ovarian Cysts in Prepubertal Girls. How Aggressive Should We Be? A Review of the Literature. J Pediatr Adolesc Gynecol 2015; 28:292.
Lack EE, Perez-Atayde AR, Murthy AS, et al. Granulosa theca cell tumors in premenarchal girls: a clinical and pathologic study of ten cases. Cancer 1981; 48:1846.
Young RH, Dickersin GR, Scully RE. Juvenile granulosa cell tumor of the ovary. A clinicopathological analysis of 125 cases. Am J Surg Pathol 1984; 8:575.
Arhan E, Cetinkaya E, Aycan Z, et al. A very rare cause of virilization in childhood: ovarian Leydig cell tumor. J Pediatr Endocrinol Metab 2008; 21:181.
Urban MD, Lee PA, Plotnick LP, Migeon CJ. The diagnosis of Leydig cell tumors in childhood. Am J Dis Child 1978; 132:494.
Henderson CG, Ahmed AA, Sesterhenn I, et al. Enucleation for prepubertal leydig cell tumor. J Urol 2006; 176:703.
Englund AT, Geffner ME, Nagel RA, et al. Pediatric germ cell and human chorionic gonadotropin-producing tumors. Clinical and laboratory features. Am J Dis Child 1991; 145:1294.
Argente J. Diagnosis of late puberty. Horm Res 1999; 51 Suppl 3:95.
Sedlmeyer IL, Palmert MR. Delayed puberty: analysis of a large case series from an academic center. J Clin Endocrinol Metab 2002; 87:1613.
Raivio T, Falardeau J, Dwyer A, et al. Reversal of idiopathic hypogonadotropic hypogonadism. N Engl J Med 2007; 357:863.
Waldstreicher J, Seminara SB, Jameson JL, et al. The genetic and clinical heterogeneity of gonadotropin-releasing hormone deficiency in the human. J Clin Endocrinol Metab 1996; 81:4388.
Zhu J, Choa RE, Guo MH, et al. A shared genetic basis for self-limited delayed puberty and idiopathic hypogonadotropic hypogonadism. J Clin Endocrinol Metab 2015; 100:E646.
Rosenfield RL. Clinical review 6: Diagnosis and management of delayed puberty. J Clin Endocrinol Metab 1990; 70:559.
Kaplowitz PB. Delayed puberty. Pediatr Rev 2010; 31:189.





