Rabia: Profilaxis en la Exposición, Diagnóstico y Manejo de la Infección.

La rabia es una de las infecciones humanas más antiguas y más temidas con la mayor tasa de mortalidad de cualquier enfermedad infecciosa. A pesar del desarrollo de la primera vacuna contra la rabia en 1885 por Louis Pasteur, la Organización Mundial de la Salud estima que en todo el mundo entre 30,000 y 70,000 personas mueren de rabia cada año. La mayoría de estas muertes ocurren en países en vías de desarrollo debido al control inadecuado de la rabia en animales domesticados.
Aunque inicialmente se pensó que un solo virus era responsable de todos los casos de rabia, esta enfermedad parece ser causada por varias especies diferentes de virus neurotrópicos de la familia Rhabdoviridae, género Lyssavirus. Las técnicas genéticas antigénicas y moleculares han demostrado que varios virus dentro de este género causan enfermedades clínicamente similares a la rabia. La secuenciación genética del virus puede ayudar a determinar el vector probable de transmisión, como un murciélago de pelo plateado o un mapache.
El virión de Lyssavirus en forma de bala contiene un genoma de ARN monocatenario que codifica cinco proteínas estructurales. Uno de estos genes codifica para una glicoproteína externa, que es una diana importante para anticuerpos neutralizantes contra el virus. El análisis de la secuencia de nucleótidos del gen que codifica la nucleoproteína interna permite la identificación de las diversas variantes del virus de la rabia y sus hospederos asociados.
Etiopatogenia de la Rabia
Los Lyssavirus tienen predilección por el tejido nervioso y se diseminan a través de los nervios periféricos hacia el sistema nervioso central (SNC). El mecanismo por el cual la rabia causa enfermedad grave del sistema nervioso central no está claro. Estos virus pueden producir disfunción neuronal, como inestabilidad autonómica, en lugar de muerte neuronal. El estrés oxidativo causado por la disfunción de las mitocondrias en las neuronas y otras células del SNC también puede ser una vía que conduzca a las anormalidades observadas en la enfermedad. Los virus se amplifican cerca del sitio de inoculación en las células musculares y posteriormente ingresan a los nervios sensoriales y motores locales. Cada virión está rodeado por una envoltura de lipoproteína cubierta con espículas de glicoproteína.
Después de la inoculación, estas proyecciones de glicoproteína se unen a los receptores de acetilcolina nicotínicos de la membrana plasmática de las células musculares, para luego introducirse a las neuronas. Sin embargo, dado que las neuronas no expresan receptores de acetilcolina, pueden existir otros receptores no identificados para permitir la entrada a las células. Posteriormente migran hacia el SNC en dirección retrógrada dentro del axoplasma de los nervios periféricos a aproximadamente 50 a 100 mm por día hasta alcanzar los ganglios de la raíz dorsal de la médula espinal. Ascienden rápidamente por la médula espinal hasta el cerebro, infectando inicialmente el diencéfalo, el hipocampo y el tallo encefálico.
La diseminación centrífuga del virus a lo largo de los nervios somáticos y autonómicos da como resultado una diseminación generalizada. La replicación vírica y diseminación ocurre en áreas altamente inervadas, como las glándulas salivales. Aunque muchas neuronas están infectadas por el virus, los hallazgos neuropatológicos son bastante sutiles en comparación con los causados por otras etiologías infecciosas de encefalitis, como el virus del herpes simple. Como ejemplo, en la autopsia, los hallazgos incluyen edema cerebral leve y congestión vascular.
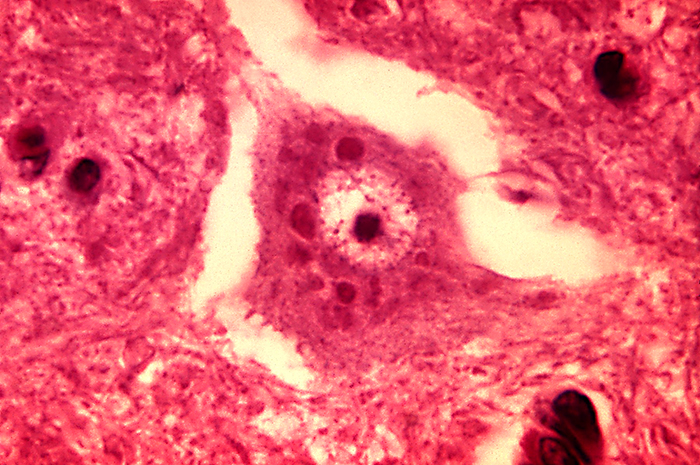
Hallazgos Histológicos
Los cambios microscópicos asociados a la infección incluyen recubrimiento perivascular con células mononucleares y activación microglial; y puede verse neuronofagia ocasional (destrucción de células nerviosas por fagocitos). Se pueden observar inclusiones densas, ovoides e intracitoplasmáticas (es decir, cuerpos de Negri) dentro de las neuronas del SNC en áreas desprovistas de inflamación o degeneración.
Susceptibilidad del Huésped a la Infección
La susceptibilidad del paciente a la infección por el virus de la rabia está relacionada con varios factores. Como ejemplo, una mordedura con contaminación salival importante en la piel expuesta de la cara y la cabeza, es más probable que resulte en una infección que una mordida en la ropa donde la saliva puede ser absorbida. Otros factores que pueden aumentar la susceptibilidad del huésped a la infección incluyen:
- La variante del virus.
- El tamaño del inóculo viral.
- El grado de inervación en el sitio de la mordedura.
- Inmunidad y genética del huésped.
Se cree que todos los mamíferos son susceptibles a la infección por el virus de la rabia, aunque las especies difieren en cuanto a su susceptibilidad relativa. Por ejemplo, los zorros, coyotes, lobos y los chacales son bastante susceptibles, mientras que las zarigüeyas son relativamente resistentes.
Epidemiología
La rabia tiene una distribución mundial con pocas excepciones, como la Antártida, Nueva Zelanda, Japón, Suecia, Noruega, España y algunas islas del Caribe.
Transmisión de la Rabia
La mayoría de las infecciones por el virus de la rabia se adquieren a través de la exposición a la saliva de la mordedura de un animal enfermo. En casos raros, la rabia es el resultado de una exposición sin mordida (p.e. virus aerosolizado en cuevas de murciélagos o en laboratorios que manipulan el virus), o trasplante de tejidos u órganos de un donante con rabia no diagnosticada. No se ha documentado la transmisión de la rabia de pacientes infectados al personal de salud o contactos del hogar, mediante fomites o superficies ambientales.
Reservorios en Animales
En los países en desarrollo, los perros rabiosos representan el 90% o más de los casos notificados de rabia transmitida a los humanos. En los Estados Unidos, la rabia canina fue responsable de la mayoría de las muertes humanas antes de la década de 1950, pero en los años setenta fue eliminada en gran parte como fuente endémica. A fines de la década de 1960, los animales salvajes surgieron como la fuente más probable de exposición humana en los Estados Unidos.
La vigilancia epidemiológica de la rabia en los Estados Unidos ha identificado a los cuatro principales reservorios animales: murciélagos, mapaches, zorrillos y zorros. La principal fuente de casos humanos han sido los murciélagos, basado en la caracterización genética de la cepa del virus de la rabia infectante. Aunque los roedores pequeños, como los jerbos, ardillas, conejillos de indias, ratas, ratones y los conejos son susceptibles a la infección, la rabia es poco común en estos animales.
Trasplante de Órganos y Tejidos
La transmisión del virus de la rabia puede ocurrir a través del trasplante de tejidos u órganos de donantes con rabia no diagnosticada en el momento de la obtención del tejido. Como ejemplo, cuatro pacientes desarrollaron después de que recibieron un riñón, un segmento arterial y un hígado de un donante de órganos en común que murió de encefalitis de causa desconocida. La tinción inmunohistoquímica y con anticuerpos de fluorescencia directa demostró el virus de la rabia en múltiples tejidos de todos los receptores.
Los hallazgos histopatológicos en el tejido cerebral de los receptores de trasplante demostraron inclusiones virales intracitoplásmicas, sugestivas de cuerpos Negri. Anticuerpos contra el virus de la rabia estuvieron presentes en tres de los cuatro receptores y en el donante, que tenía antecedentes de mordedura de murciélago.
Periodo de Incubación de la Rabia
El período de incubación promedio de la rabia es de uno a tres meses, pero puede variar de varios días a muchos años después de la exposición. En pacientes trasplantados, el tiempo entre el trasplante de los órganos infectados y los síntomas en el receptor puede variar. En un informe, la encefalitis se desarrolló en cuatro receptores dentro de los 30 días posteriores al trasplante. En otro caso donde la rabia se transmitió de un donante a un receptor de trasplante, el receptor murió de rabia 18 meses después del trasplante.
El período de incubación es más corto en pacientes con una exposición que ocurre en áreas ricamente inervadas (p.e. la cara en comparación con las extremidades). Períodos de incubación más largos también pueden estar relacionados con una profilaxis inadecuada de la rabia o una nueva exposición desconocida.
Así se presenta tu paciente
Una vez que el paciente ha mostrado signos clínicos de la enfermedad, la rabia generalmente conduce a encefalopatía progresiva y muerte, con raras excepciones. La rabia generalmente cursa subclínica durante la fase prodrómica, que comienza con síntomas inespecíficos, como fiebre baja, escalofríos, malestar general, mialgias, debilidad, fatiga, anorexia, dolor de garganta, náuseas, vómitos, cefalea y, ocasionalmente, fotofobia. Esta etapa dura desde unos pocos días hasta aproximadamente una semana. Parestesias que irradian proximalmente desde el sitio de una herida sugieren infección por rabia.
El paciente puede describir una variedad de síntomas que incluyen dolor, sensibilidad, hormigueo, picazón, ardor, sensación de temperatura local anormal o entumecimiento en el sitio. Además, el mioedema por percusión (contracción y abultamiento del músculo en el sitio de percusión) puede estar presente durante el pródromo y durante toda la enfermedad.
Rabia Clínica
La infección puede evolucionar a dos formas principales de enfermedad: la rabia encefálica y la paralítica, ambas empezando con síntomas prodrómicos inespecíficos como se describió anteriormente. La rabia encefalítica es más común (80% de los casos). Ocasionalmente, los casos atípicos también se han descrito en asociación con la rabia transmitida por los murciélagos.
Las características atípicas incluyen déficits sensoriales o motores, movimientos coreiformes de la extremidad mordida durante la fase prodrómica, signos de focalidad del tallo encefálico, parálisis de los pares craneales, mioclonos y las convulsiones. El curso de la enfermedad se ve influido por la extensión de la mordedura, su proximidad a la cabeza y la cantidad de secreción a la que fue expuesta.
Rabia Encefálica
La presentación clásica de la rabia encefálica incluye fiebre, hidrofobia, espasmos faríngeos e hiperactividad que disminuye a parálisis, coma y muerte.
Hidrofobia y Aerofobia
La hidrofobia es el dato clínico más característico de la rabia, el cual ocurre en el 33 al 50% de los pacientes. Después de una sensación inicial de incomodidad en la garganta o disfagia, el paciente de repente desarrolla un terror abrumador al agua basado en espasmos musculares involuntarios de la faringe durante los intentos por beber. Conforme la enfermedad progresa, incluso el ver o escuchar mencionar el agua pueden desencadenar estos espasmos involuntarios.
La aerofobia también es patognomónica de la rabia, aunque ocurre con menos frecuencia que la hidrofobia (aproximadamente 9% en una serie de casos). Los espasmos faríngeos se desencadenan al sentir una corriente de aire y pueden durar aproximadamente de 5 a 15 segundos. Los espasmos inspiratorios dolorosos del diafragma y los músculos inspiratorios accesorios pueden llevar a aspiración, tos, ahogo, vómitos e hipo; cuando son severos, estos espasmos pueden llevar a asfixia y paro respiratorio.
Alteraciones Musculares
Los músculos faciales pueden contraerse y producir una mueca, y el cuello y la espalda pueden hiperextenderse por la espasticidad muscular (opistótonos). Los pacientes pueden presentar disartria, disfagia, diplopía o vértigo. La disfagia se informó en aproximadamente la mitad de los casos en una serie de casos retrospectiva.
Disautonomía
Se observa inestabilidad autonómica en aproximadamente el 25% de los pacientes. Los signos de hiperactividad del sistema nervioso autónomo incluyen hipersalivación, lagrimeo, sudoración, “piel de gallina” y midriasis. Se ha descrito hiperpirexia alternando con hipotermia.La taquicardia y las arritmias cardíacas son frecuentes y pueden estar relacionadas con miocarditis por una lesión viral directa.
Alteración del Estado Mental
La agitación y combatividad también son frecuentes (aproximadamente el 50% de los pacientes). De forma intermitente, el paciente puede mostrar síntomas de excitación generalizada o hiperexcitabilidad asociada con desorientación, conciencia fluctuante, inquietud, agitación y alucinaciones visuales o auditivas. Los pacientes pueden volverse agresivos y maniáticos, seguido de períodos de calma.
En la exploración física se observan cambios en el estado mental, aumento del tono muscular y reflejos osteotendinosos con respuestas plantares extensoras y fasciculaciones. La rigidez de nuca puede estar presente. Una vez que el paciente desarrolla coma, generalmente se observa parálisis flácida con arreflexia generalizada. Los pacientes generalmente mueren como resultado del colapso respiratorio y vascular.
Rabia Paralítica
Menos del 20% de los pacientes con rabia se presentan con una parálisis ascendente, que puede simular el síndrome de Guillain-Barré. Estos pacientes tienen poca evidencia de compromiso cerebral hasta en etapas avanzadas de la enfermedad. Después de los síntomas prodrómicos descritos anteriormente, el paciente desarrolla una parálisis flácida. La parálisis suele ser más prominente en la extremidad mordida, y luego se extiende de forma simétrica o asimétrica. En la exploración física se observan fasciculaciones; los reflejos plantares y osteotendinosos se pierden.
El paciente puede quejarse de cefalea y dolor en los músculos afectados con leve alteración sensorial. En ocasiones se observan rigidez de nuca y parálisis de pares craneales, mientras que la hidrofobia es inusual. A medida que la parálisis asciende, comienza una paraplejía importante con pérdida del tono de esfínteres y posterior parálisis de los músculos de la deglución y la respiración que conduce a la muerte.
Complicaciones
La mayoría de los pacientes con rabia mueren dentro de las dos semanas posteriores al inicio del coma, aunque se han descrito periodos más largos con apoyo de cuidados intensivos. Además, desde el 2004 se han reportado algunos casos de supervivencia después de la rabia clínica. Los pacientes a menudo mueren por complicaciones, como asfixia y paro respiratorio secundario a espasmos musculares o convulsiones generalizadas no controladas en la rabia encefálica; o parálisis respiratoria en la rabia paralítica. Se han reportado arritmias supraventriculares, bloqueo auriculoventricular, bradicardia sinusal y paro sinusal con un segmento ST inespecífico y cambios en la onda T. Se ha encontrado miocarditis en la necropsia con evidencia de invasión viral e infiltración linfocítica.
Estudios de Imagen y Laboratorio
Los exámenes de laboratorio no son específicos. A menudo se observa leucocitosis. Cuando existen características clínicas sugerentes de meningitis, una punción lumbar puede mostrar pleocitosis linfocítica (media de 60 células/uL). Las proteínas en el LCR están característicamente elevadas, pero típicamente menores a 100 mg/dL, con glucosa normal. Un LCR hemorrágico no se ve característicamente en la rabia.
La tomografía computarizada es generalmente normal en la fase temprana de la enfermedad. En etapas posteriores, se puede ver edema cerebral. La RM puede mostrar áreas de mayor señalización de T2 en el hipocampo, hipotálamo y el tallo encefálico.
Diagnóstico de Rabia
La rabia debe considerarse en el diagnóstico diferencial de un paciente que presenta progresiva aguda, independientemente del antecedente de mordedura de un animal o exposición conocida. La rabia encefálica debe sospecharse en función de la hidrofobia y la aerofobia.
Diagnóstico por Laboratorio
El diagnóstico antemortem de la rabia requiere de varias muestras (saliva, piel, suero, LCR) y múltiples modalidades de prueba, ya que la sensibilidad de cualquier prueba individual es limitada. Los títulos de anticuerpos en suero, por ejemplo, pueden no ser positivos hasta más tarde en el curso de la enfermedad, si es que lo hacen. Sin embargo, la sensibilidad de una combinación de pruebas se aproxima al 100%, dependiendo de la calidad de la muestra, el momento de la recolección y la experiencia en el diagnóstico.
La precisión de las pruebas de varias muestras biológicas en el diagnóstico de la rabia se evaluó en un estudio longitudinal prospectivo de 51 pacientes con encefalitis en Madagascar, Camboya y Francia. Un total de 425 muestras (incluyendo saliva, orina, suero y biopsias de piel) se obtuvieron durante la hospitalización aguda o post mortem. Las pruebas de reacción en cadena de la polimerasa (PCR) de biopsias de piel se asociaron con alta sensibilidad y especificidad (98 y 98.3%, respectivamente), seguidas de saliva (63.2 y 70.2%, respectivamente). La sensibilidad de las muestras de saliva mejoró al 100% cuando se obtuvieron al menos tres muestras. La sensibilidad general de las muestras de orina y suero fue pobre.
La interpretación de los títulos de anticuerpos contra la rabia dependerá de la muestra específica y el antecedente de vacunación. Por ejemplo, los anticuerpos séricos contra el virus de la rabia pueden no estar presentes hasta varios días después del inicio de los signos clínicos y pueden aparecer aún más tarde en el LCR. Si no se ha administrado una vacuna o inmunoglobulina antirrábica, la presencia de anticuerpos contra el virus de la rabia en suero es diagnóstico de infección.
Un paciente que ha sido vacunado tendrá anticuerpos contra la rabia en el suero. Por tanto, en el paciente vacunado, se debe obtener una segunda muestra unos días después para ver si los títulos de anticuerpos están aumentando, lo que sería indicativo de infección. Sin embargo, el anticuerpo contra el virus en una muestra de LCR, independientemente de los antecedentes de vacunación, sugiere infección. El análisis del LCR no distingue a la rabia de otras encefalitis.
Diagnóstico Post mortem
Las pruebas post mortem implican examinar el tallo del encéfalo y otros tejidos neurales directamente, utilizando tinción de inmunofluorescencia para antígenos virales. La inflamación mononuclear con abundantes antígenos del virus de la rabia puede verse distribuida de manera difusa. Los cuerpos de Negri, inclusiones citoplasmáticas eosinofílicas neuronales, son patognomónicas de la rabia, pero no están presentes en todos los casos.
Diagnósticos Diferenciales
La fase prodrómica inespecífica se puede confundir con una multitud de trastornos infecciosos, como una enfermedad viral inespecífica, mononucleosis o bacteriemia. El diagnóstico diferencial dependerá en gran medida de si el paciente desarrolla rabia encefálica o paralítica. En pacientes con síntomas y signos de encefalitis, deben descartarse otras infecciones más comunes (p.e. virus del herpes simple, virus del Nilo occidental) y otros trastornos no infecciosos (p.e. Vasculitis del sistema nervioso central, encefalopatía tóxica o metabólica.
Tratamiento de la Rabia
Aunque la rabia suele prevenirse después de la exposición con profilaxis antirrábica (p.e. limpieza de heridas y administración de vacuna contra la rabia e inmunoglobulina), la necesidad de profilaxis no siempre se identifica de manera oportuna y puede no estar disponible en algunas áreas. Además, la rabia humana puede presentarse sin el antecedente (consciente) de exposición a la mordedura de un animal, generalmente por mordedura de un murciélago.
Enfoques de Tratamiento
En pacientes con rabia confirmada o sospechada, las opciones de tratamiento incluyen un enfoque paliativo o uno agresivo. Ello se ve influido por múltiples factores de los pacientes con rabia, incluidos el pronóstico y los riesgos del tratamiento. En general, se sigue un enfoque paliativo en pacientes con pocas probabilidades de sobrevivir o que no acepten la supervivencia con graves secuelas neurológicas.
Los factores asociados a un pronóstico precario incluyen adultos mayores, comórbidos, enfermedad avanzada, falta de vacunación contra la rabia, infección causada por el virus de la rabia canina y pruebas de diagnóstico positivas para el antígeno/ARN del virus de la rabia y negativas para los anticuerpos contra la rabia.La consideración de un enfoque agresivo sería razonable para pacientes que tienen una mayor probabilidad de supervivencia y que aceptarían graves secuelas neurológicas.
Los factores que pueden asociarse con un curso de enfermedad más favorable incluyen pacientes jóvenes, ausencia de comórbidos, una o más dosis de vacuna contra la rabia antes del inicio de los síntomas o signos, manifestaciones clínicas consistentes con enfermedad temprana, infección causada por el virus de la rabia del murciélago y pruebas de diagnóstico que son negativas para el antígeno/ARN del virus de la rabia y positivas para los anticuerpos contra la rabia.
Tratamiento Paliativo
Una vez que se ha tomado la decisión de adoptar un enfoque paliativo para el cuidado de un paciente con rabia, se debe hacer hincapié en el cuidado de la comodidad en un hospital con el uso liberal de sedantes y analgésicos para aliviar el sufrimiento. Una habitación privada y tranquila es altamente deseable. Las benzodiazepinas, como el diazepam, son útiles para la sedación y la relajación muscular y pueden administrarse por vía intravenosa, intramuscular o por vía rectal. Lorazepam y midazolam son buenas alternativas, y ambas se pueden administrar por vía intravenosa o subcutánea.
El haloperidol, que puede administrarse por vía subcutánea o intramuscular, puede usarse para una variedad de manifestaciones clínicas, incluyendo ansiedad, agitación, hiperexcitabilidad, delirio, alucinaciones y agresión. Para la analgesia, la morfina puede administrarse por vía intravenosa o subcutánea. Las secreciones salivales excesivas se pueden tratar con anticolinérgicos, incluidos escopolamina y glicopirrolato. La sensación de sed se puede aliviar con trozos de hielo en la boca. La fiebre puede tratarse con medios físicos y antipiréticos, que incluyen acetaminofén y/o ibuprofeno.
Si bien se prefieren los cuidados paliativos en un hospital, en algunas comunidades, puede ser importante que el paciente sea dado de alta del hospital y regrese a su hogar en busca de privacidad, para reducir los costos hospitalarios y/o que se realicen eventos religiosos antes de la muerte.
Tratamiento Agresivo
En raras ocasiones, los pacientes con rabia han sobrevivido después de cuidados intensivos. Un enfoque de tratamiento agresivo implica una combinación de cuidados de soporte y el uso no aprobado de tratamientos actualmente disponibles, los cuales, aunque no han sido probados, pueden tener beneficios basados en la comprensión actual de la enfermedad. Una mejor comprensión de los mecanismos básicos que subyacen a la patogénesis de la rabia puede proporcionar ideas para el desarrollo futuro de nuevos tratamientos.
Medidas de Soporte en la UCI
Las medidas de soporte en una unidad de cuidados intensivos es esencial para un enfoque agresivo. Existen muchas complicaciones potenciales de la rabia, particularmente cardíacas y respiratorias, que pueden abordarse mejor con un equipo de especialistas con amplia experiencia. Es muy probable que las medidas de soporte en unidades de cuidados intensivos sea el factor más importante para todos los sobrevivientes de la rabia hasta la fecha.
Tratamientos Combinados
No hay datos que respalden un enfoque específico del tratamiento para pacientes con rabia. Sin embargo, de forma similar al abordaje terapéutico del cáncer, la infección por el virus de inmunodeficiencia humana (VIH) y la infección crónica por el virus de la hepatitis C, el uso de una combinación de tratamientos puede tener la mayor probabilidad de éxito en el tratamiento de la rabia. Esto implica combinar tratamientos en diferentes categorías terapéuticas (por ejemplo, inmunoterapia, terapia antiviral y terapia neuroprotectora) como se describe a continuación.
Inmunoterapia
La inmunoterapia con la vacuna contra la rabia o la inmunoglobulina es controvertida. Es razonable administrar la vacuna contra la rabia si el paciente no ha recibido un ciclo completo de profilaxis posterior a la exposición. La disminución de la viremia en la rabia se asocia con el desarrollo de una respuesta inmune, y un sello distintivo importante de esta respuesta es la presencia de anticuerpos neutralizantes contra el virus de la rabia en el suero y el líquido cefalorraquídeo. Sin embargo, se desconoce si es prudente administrar la vacuna a un paciente con rabia. Las vacunas antirrábicas inactivadas no provocan una respuesta citotóxica de las células T y, por tanto, su valor en la reducción de la viremia puede ser limitado. No existen vacunas de rabia atenuadas en vivo aprobadas para su uso en humanos.
Inmunoglobulina antirrábica humana (HRIG)
La HRIG no se administra de manera rutinaria a pacientes con rabia porque las inmunoglobulinas no cruzan la barrera hematoencefálica intacta y, por tanto, se desconoce en qué medida facilitan la eliminación del virus. Sin embargo, el uso de la HRIG junto con una estrategia para mejorar la entrada de fármacos al sistema nervioso central (SNC) (p.e. osmóticos u ondas de ultrasonido) puede ser beneficioso. La eficacia y la seguridad de la administración intratecal de la HRIG son desconocidas.
Tratamiento antiviral
Un enfoque de tratamiento agresivo incluye el uso de uno o más agentes antivirales con el objetivo de reducir la diseminación viral a las células no infectadas. La terapia antiviral se usa a pesar de la falta de evidencia sobre la eficacia de cualquier fármaco disponible. Como no hay datos que recomienden un fármaco sobre el otro, el enfoque del tratamiento se basa exclusivamente en la experiencia y a menudo se ve influido por la toxicidad que el médico y el paciente (o la familia del paciente) están dispuestos a tolerar.
Se han usado tres agentes (interferón-alfa, ribavirina y amantadina) en el tratamiento de adultos con rabia. Estos agentes se han asociado con complicaciones neuropsiquiátricas, hematológicas, gastrointestinales y/o autoinmunes. Un cuarto medicamento, el favipiravir, ha demostrado eficacia en estudios con animales, pero no está aprobado para uso humano en la mayoría de los países.
Si se usa interferón-alfa, debe administrarse por vía intratecal (al menos 300,000 unidades internacionales/día) a través de administración lumbar o una infusión intraventricular (con un reservorio de Ommaya). La penetración del SNC puede ser limitada en la administración intravenosa o intramuscular. Dado que hay incertidumbre sobre la penetración de ribavirina en el SNC, si se usa, también se debe administrar por vía intratecal o con un agente que aumente la penetración del SNC, si es posible.
Terapia Neuroprotectora
Las terapias neuroprotectoras producen beneficios duraderos al influir favorablemente en la etiología o patogénesis subyacente y prevenir la aparición de la enfermedad o el deterioro clínico. El desarrollo de terapias neuroprotectoras para trastornos neurológicos agudos se encuentra en su infancia a pesar de muchos estudios de investigación publicados. No se conocen agentes neuroprotectores efectivos para su uso en la rabia. No se conocen agentes neuroprotectores efectivos para su uso en la rabia. Sin embargo, la hipotermia terapéutica (inducida) del cerebro (control de temperatura específica), administrada ya sea con un casco de enfriamiento o refrigeración intranasal, podría considerarse como un tratamiento adyuvante potencial para la rabia; ello a fin de ralentizar la progresión de la enfermedad, reducir la lesión neuronal y proporcionar tiempo para el desarrollo de una respuesta inmune.
La hipotermia cerebral es la única terapia neuroprotectora efectiva demostrada para la lesión cerebral aguda en un paro cardíaco y se utiliza en la práctica clínica para esta indicación, aunque algunas pruebas sugieren que se deben realizar más estudios para confirmar la eficacia.
Tratamientos a Evitar
Los tratamientos con corticosteroides, la minociclina, el coma terapéutico y la profilaxis del vasoespasmo cerebral no se deben utilizar para el tratamiento de la rabia.
Prevención de la Infección
No hay casos documentados de transmisión del virus de la rabia de un paciente a un profesional de la salud. Sin embargo, dado el riesgo teórico, las personas que cuidan a un paciente con rabia deben hacer uso de estrategias para reducir el riesgo de transmisión. Las secreciones orales son especialmente preocupantes debido a la posibilidad de que puedan contener virus infeccioso de la rabia y dar lugar a la transmisión.
Control de la Exposición
Las medidas para el control de infección deben ser practicadas por todos los visitantes y los trabajadores de la salud que atienden a pacientes con sospecha o confirmación de rabia. Las diferentes instituciones pueden variar en su enfoque, pero como mínimo, los miembros de la familia y los trabajadores de la salud deben utilizar medidas estándar al cuidar a un paciente con rabia para minimizar la necesidad de una profilaxis posterior a la exposición. Como ejemplo, los trabajadores de la salud deben usar batas, cubrebocas, guantes y protección para los ojos y la cara cuando exista el riesgo de aerosoles y salpicaduras (por ejemplo, intubación y succión).
La exposición cutánea, percutánea o de la mucosa a los fluidos corporales del paciente (incluidas las secreciones salivales) o los tejidos justifican el inicio de profilaxis antirrábica posterior a la exposición (limpieza de heridas y administración de vacuna antirrábica e inmunoglobulina). Tales exposiciones típicamente ocurren antes de que se considere el diagnóstico de rabia en el paciente.
Referencias Bibliográficas
Fauquet CM, Mayo MA, Maniloff J, et al. Virus Taxonomy. Eighth report of the international committee on the nomenclature of viruses, Elsevier Academic Press, Inc., San Diego 2005.
Kuzmin IV, Hughes GJ, Botvinkin AD, et al. Phylogenetic relationships of Irkut and West Caucasian bat viruses within the Lyssavirus genus and suggested quantitative criteria based on the N gene sequence for lyssavirus genotype definition. Virus Res 2005; 111:28.
Hankins DG, Rosekrans JA. Overview, prevention, and treatment of rabies. Mayo Clin Proc 2004; 79:671.
Jackson AC. Diabolical effects of rabies encephalitis. J Neurovirol 2016; 22:8.
Murphy FA, Bauer SP. Early street rabies virus infection in striated muscle and later progression to the central nervous system. Intervirology 1974; 3:256.
Lentz TL, Burrage TG, Smith AL, et al. Is the acetylcholine receptor a rabies virus receptor? Science 1982; 215:182.
Warrell MJ, Warrell DA. Rabies and other lyssavirus diseases. Lancet 2004; 363:959.
Hemachudha T, Laothamatas J, Rupprecht CE. Human rabies: a disease of complex neuropathogenetic mechanisms and diagnostic challenges. Lancet Neurol 2002; 1:101.
Wilson JM, Hettiarachchi J, Wijesuriya LM. Presenting features and diagnosis of rabies. Lancet 1975; 2:1139.
Fishbein DB, Robinson LE. Rabies. N Engl J Med 1993; 329:1632.
Jackson AC. Recovery from rabies. N Engl J Med 2005; 352:2549.
Bleck TP, Rupprecht CE. Rhabdoviruses. In: Principles and Practice of Infectious Diseases, Sixth Ed, Mandell GL, Bennett JE, Dolin R (Eds), Churchill Livingstone, Philadelphia 2005. p.2047.
World Health Organization. WHO expert consultation on rabies. WHO Tech Rep Ser 2005; Abstract 931, pg. 88.
Human rabies prevention–United States, 1999. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 1999; 48:1.
Knobel DL, Cleaveland S, Coleman PG, et al. Re-evaluating the burden of rabies in Africa and Asia. Bull World Health Organ 2005; 83:360.
Noah DL, Drenzek CL, Smith JS, et al. Epidemiology of human rabies in the United States, 1980 to 1996. Ann Intern Med 1998; 128:922.
Krebs JW, Noll HR, Rupprecht CE, Childs JE. Rabies surveillance in the United States during 2001. J Am Vet Med Assoc 2002; 221:1690.
Krebs JW, Mandel EJ, Swerdlow DL, Rupprecht CE. Rabies surveillance in the United States during 2004. J Am Vet Med Assoc 2005; 227:1912.
Winkler WG, Fashinell TR, Leffingwell L, et al. Airborne rabies transmission in a laboratory worker. JAMA 1973; 226:1219.
Centers for Disease Control and Prevention. Rabies in a laboratory worker—New York. MMWR Morb Mortal Wkly Rep 1977; 26:183.
Davis AD, Rudd RJ, Bowen RA. Effects of aerosolized rabies virus exposure on bats and mice. J Infect Dis 2007; 195:1144.
Maier T, Schwarting A, Mauer D, et al. Management and outcomes after multiple corneal and solid organ transplantations from a donor infected with rabies virus. Clin Infect Dis 2010; 50:1112.
Helmick CG, Tauxe RV, Vernon AA. Is there a risk to contacts of patients with rabies? Rev Infect Dis 1987; 9:511.
Murphy TV, Slade BA, Broder KR, et al. Prevention of pertussis, tetanus, and diphtheria among pregnant and postpartum women and their infants recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2008; 57:1.
Blanton JD, Hanlon CA, Rupprecht CE. Rabies surveillance in the United States during 2006. J Am Vet Med Assoc 2007; 231:540.
Feder HM Jr, Petersen BW, Robertson KL, Rupprecht CE. Rabies: still a uniformly fatal disease? Historical occurrence, epidemiological trends, and paradigm shifts. Curr Infect Dis Rep 2012; 14:408.
Messenger SL, Smith JS, Rupprecht CE. Emerging epidemiology of bat-associated cryptic cases of rabies in humans in the United States. Clin Infect Dis 2002; 35:738.
Halpin K, Hyatt AD, Plowright RK, et al. Emerging viruses: coming in on a wrinkled wing and a prayer. Clin Infect Dis 2007; 44:711.
Centers for Disease Control and Prevention (CDC). Human rabies–Indiana and California, 2006. MMWR Morb Mortal Wkly Rep 2007; 56:361.
Srinivasan A, Burton EC, Kuehnert MJ, et al. Transmission of rabies virus from an organ donor to four transplant recipients. N Engl J Med 2005; 352:1103.
Vora NM, Basavaraju SV, Feldman KA, et al. Raccoon rabies virus variant transmission through solid organ transplantation. JAMA 2013; 310:398.
Houff SA, Burton RC, Wilson RW, et al. Human-to-human transmission of rabies virus by corneal transplant. N Engl J Med 1979; 300:603.
Javadi MA, Fayaz A, Mirdehghan SA, Ainollahi B. Transmission of rabies by corneal graft. Cornea 1996; 15:431.
Zhou H, Zhu W, Zeng J, et al. Probable Rabies Virus Transmission through Organ Transplantation, China, 2015. Emerg Infect Dis 2016; 22:1348.
Rupprecht CE, Hanlon CA, Hemachudha T. Rabies re-examined. Lancet Infect Dis 2002; 2:327.
Boland TA, McGuone D, Jindal J, et al. Phylogenetic and epidemiologic evidence of multiyear incubation in human rabies. Ann Neurol 2014; 75:155.
Hemachudha T, Ugolini G, Wacharapluesadee S, et al. Human rabies: neuropathogenesis, diagnosis, and management. Lancet Neurol 2013; 12:498.
Smith JS, Fishbein DB, Rupprecht CE, Clark K. Unexplained rabies in three immigrants in the United States. A virologic investigation. N Engl J Med 1991; 324:205.
Hattwick MA. Reactions to rabies. N Engl J Med 1972; 287:1204.
Centers for Disease Control and Prevention (CDC). Imported human rabies in a U.S. Army soldier – New York, 2011. MMWR Morb Mortal Wkly Rep 2012; 61:302.
Transactions of the Royal Society of Tropical Medicine and Hygiene Vol 70 No 3. 1976 (Accessed on March 16, 2012).
Hemachudha T, Phanthumchinda K, Phanuphak P, Manutsathit S. Myoedema as a clinical sign in paralytic rabies. Lancet 1987; 1:1210.
Centers for Disease Control and Prevention (CDC). Recovery of a patient from clinical rabies–Wisconsin, 2004. MMWR Morb Mortal Wkly Rep 2004; 53:1171.
Metze K, Feiden W. Rabies virus ribonucleoprotein in the heart. N Engl J Med 1991; 324:1814.
Rubin RH, Sullivan L, Summers R, et al. A case of human rabies in Kansas: epidemiologic, clinical, and laboratory considerations. J Infect Dis 1970; 122:318.
Burton EC, Burns DK, Opatowsky MJ, et al. Rabies encephalomyelitis: clinical, neuroradiological, and pathological findings in 4 transplant recipients. Arch Neurol 2005; 62:873.
Venkatesan A, Tunkel AR, Bloch KC, et al. Case definitions, diagnostic algorithms, and priorities in encephalitis: consensus statement of the international encephalitis consortium. Clin Infect Dis 2013; 57:1114.
Anderson LJ, Nicholson KG, Tauxe RV, Winkler WG. Human rabies in the United States, 1960 to 1979: epidemiology, diagnosis, and prevention. Ann Intern Med 1984; 100:728.
Dacheux L, Reynes JM, Buchy P, et al. A reliable diagnosis of human rabies based on analysis of skin biopsy specimens. Clin Infect Dis 2008; 47:1410.





