Absceso Cerebral: Revisión del Diagnóstico y Tratamiento.

El absceso cerebral es una colección focal dentro del parénquima cerebral, que puede surgir como una complicación de una variedad de infecciones, trauma o cirugía. A continuación te presentamos una revisión con las claves diagnósticas y terapéuticas de este padecimiento.
Las bacterias y otros patógenos pueden invadir el cerebro por diseminación directa o por siembra hematógena. La diseminación directa representa del 20 al 60% de los casos de absceso cerebral, mientras que la hematógena ocasiona múltiples lesiones.
Diseminación Directa
La diseminación directa de organismos de un sitio contiguo generalmente causa un único absceso cerebral. Las infecciones primarias que pueden propagarse directamente a la corteza cerebral incluyen:
- Otitis media y mastoiditis subaguda y crónica (diseminada al lóbulo temporal inferior y al cerebelo)
- Senos frontales o etmoidales (diseminados a los lóbulos frontales)
- Infección dental (generalmente se propaga a los lóbulos frontales)
El absceso cerebral como complicación de las infecciones del oído ha disminuido en frecuencia, especialmente en los países desarrollados. Por el contrario, el absceso cerebral derivado de una rinosinusitis sigue siendo una consideración importante tanto en adultos como en niños.
Las heridas de bala en el cerebro pueden producir tejido necrótico y dejar fragmentos de metal que pueden servir como foco de infección. Otros cuerpos extraños que se han asociado a abscesos cerebrales incluyen la punta de lápiz alojada en el ojo y un fragmento de césped. En estos casos, el absceso cerebral puede desarrollarse muchos años después de la lesión. Además, el absceso cerebral a veces puede ser el resultado de un traumatismo craneofacial.
El absceso cerebral también puede complicar los procedimientos neuroquirúrgicos. El desarrollo de absceso cerebral después de la neurocirugía puede retrasarse. Por ejemplo, en un informe de dos casos de absceso cerebral posterior a una cirugía por schwannoma vestibular (neuroma acústico), un paciente desarrolló hallazgos neurológicos sutiles tres meses después de la cirugía; un segundo paciente presentó convulsiones 15 meses después de la cirugía, que se había complicado con meningitis por Pseudomonas aeruginosa.
Diseminación Hematógena
Los abscesos cerebrales asociados a bacteriemia suelen dar lugar a múltiples abscesos que se localizan con mayor frecuencia en la distribución de la arteria cerebral media. Las lesiones generalmente se forman en la unión de la sustancia gris y blanca donde el microinfarto daña la barrera hematoencefálica. Las condiciones que conducen a la siembra hematógena del cerebro incluyen:
- Infecciones pulmonares crónicas, como abscesos pulmonares y empiema, a menudo en pacientes con bronquiectasias o fibrosis quística.
- Infecciones de la piel
- Infecciones pélvicas
- Infecciones intraabdominales
- Dilatación esofágica y esclerosis endoscópica de venas varicosas esofágicas
- Endocarditis bacteriana (el absceso cerebral complica de 2 a 4% de los casos)
- Cardiopatías congénitas cianóticas (más comunes en niños)
- Corto circuito intrapulmonar de derecha a izquierda en pacientes con malformaciones arteriovenosas pulmonares.
Hasta el 10% de los pacientes con malformaciones arteriovenosas pulmonares desarrollan abscesos cerebrales. Dado que la mayoría de estos pacientes tienen telangiectasia hemorrágica hereditaria subyacente, a menudo tienen antecedentes de epistaxis recurrentes y telangiectasias mucocutáneas visibles. Cabe resaltar que en 20 a 40% de los pacientes con absceso cerebral no se puede identificar ningún sitio primario de infección o afección subyacente. La ubicación de un absceso cerebral refleja el sitio de la infección primaria que se disemina a la corteza cerebral. Estas ubicaciones en el cerebro, en orden de frecuencia decreciente, son:
- Lóbulos frontales o temporales
- Frontoparietal
- Parietal
- Cerebelo
- Occipital
Patología
Se requiere comprensión de la patología del absceso cerebral para una interpretación correcta de los hallazgos por tomografía computarizada y resonancia magnética. Los cambios histológicos dependen del tiempo de evolución de la infección. La lesión temprana (de una a dos semanas) está deficientemente demarcada y se asocia con edema localizado. Hay evidencia de inflamación aguda pero no hay datos de necrosis tisular. Esta etapa temprana se conoce comúnmente como cerebritis. Después de dos a tres semanas, ocurre necrosis y licuefacción, y la lesión es rodeada por una cápsula fibrótica.
Microbiología del Absceso Cerebral
Las causas más frecuentes de absceso cerebral son Streptococcus y Staphylococcus spp., siendo Streptococci viridans y Staphylococcus aureus las más comunes. Los informes de casos implican a una amplia variedad de organismos como causa del absceso cerebral. Los patógenos involucrados dependen de la infección primaria, la edad del paciente y su estado inmunológico.
Los pacientes inmunocomprometidos presentan una amplia gama de organismos, incluyendo hongos, como la etiología del absceso cerebral, mientras que las bacterias son las más comunes en individuos inmunocompetentes. El patógeno aislado de un absceso cerebral frecuentemente proporciona la clave del sitio primario de infección y de cualquier condición subyacente potencial en el huésped.
| Fuente de Infección | Patógenos asociados |
|---|---|
| Senos paranasales | Streptococcus spp.(especialmente S. milleri), Haemophilus spp., Bacteroides spp., Fusobacterium spp. |
| Infección dental | Streptococcus spp., Bacteroides spp., Prevotella spp., Fusobacterium spp., Haemophilus spp. |
| Infecciones de oído | Enterobacteriaceae, Streptococcus spp., Pseudomonas aeruginosa, Bacteroides spp. |
| Infecciones pulmonares | Streptococcus spp., Fusobacterium spp., Actinomyces spp. |
| Tracto urinario | Pseudomonas aeruginosa, Enterobacter spp. |
| Traumatismo craneoencefálico penetrante | Staphylococcus aureus, Enterobacter spp., Clostridium spp. |
| Procedimientos neuroquirúrgicos | Staphylococcus spp., Streptococcus spp., Pseudomonas aeruginosa, Enterobacter spp. |
| Endocarditis | Estreptococos Viridans, S. aureus |
| Malformaciones cardíacas congénitas (especialmente shunts de derecha a izquierda) | Streptococcus spp. |
Anaeróbios
Las bacterias anaerobias están comúnmente involucradas en los abscesos cerebrales y se asocian con lesiones únicas que se originan de infecciones otorrinolaríngeas. Sin embargo, las infecciones intraabdominales o pélvicas ocasionalmente pueden conducir a una bacteriemia con un organismo anaeróbico con siembra en la corteza cerebral. Los anaerobios en estos casos generalmente reflejan la flora del colon o del tracto genital femenino.
Los anaerobios más frecuentes cultivados a partir de un absceso cerebral incluyen estreptococos anaerobios, Bacteroides spp. (incluyendo B. fragilis), Prevotella melaninogénica, Cutibacterium (anteriormente Propionibacterium), Fusobacterium, Eubacterium, Veillonella, y Actinomyces.
Aerobios
Los cocos grampositivos se encuentran con frecuencia e incluyen a Streptococcus viridans, Streptococcus milleri, estreptococos microaerófilos, Streptococcus pneumoniae (raro), y Staphylococcus aureus. S. aureus es un patógeno frecuente en el absceso cerebral posterior a traumatismo o procedimiento neuroquirúrgico. Se han descrito casos de absceso cerebral por S. aureus resistente a meticilina adquirido en la comunidad. S. milleri (también llamado S. anginosus) es particularmente común; este organismo posee enzimas proteolíticas que predisponen a la necrosis del tejido y a la formación de abscesos.
En raras ocasiones, Rhodococcus equi se ha asociado con abscesos cerebrales, principalmente en pacientes inmunocomprometidos. Las bacterias aeróbias gramnegativas se han aislado de abscesos cerebrales posterior a una neurocirugía o traumatismo craneoencefálico o cuando una infección ótica es el probable foco de infección. Cuando se aíslan bacilos gramnegativos, Klebsiella pneumoniae, Pseudomonas spp., Escherichia coli y Proteus spp. son los más comunes. Patógenos menos comunes incluyen a Haemophilus aphrophilus, Actinobacillus actinomycetemcomitans, Salmonella, y Enterobacter spp.
El absceso cerebral por Klebsiella pneumoniae con o sin meningitis puede ocurrir como una manifestación de la infección metastásica asociada al absceso hepático primario adquirido en la comunidad. Este síndrome se observa principalmente en el sudeste asiático, especialmente en Taiwán.
Pacientes inmunocomprometidos
El espectro de organismos, particularmente los patógenos oportunistas, es mucho más amplio en el huésped inmunocomprometido con absceso cerebral. Toxoplasma gondii puede reactivarse cuando la inmunidad celular se ve comprometida. Listeria puede causar abscesos cerebrales únicos o múltiples en el tallo encefálico, especialmente en pacientes que reciben corticosteroides. La mortalidad es tres veces mayor en estos pacientes en comparación con aquellos con abscesos cerebrales causados por otras bacterias.
Nocardia asteroides, un organismo común en el suelo, puede ingresar al torrente sanguíneo a través de los pulmones e infectar la corteza cerebral. Aspergillus, Cryptococcus neoformans y Coccidioides immitis aussi pueden entrar a través de los pulmones y posteriormente invadir la corteza cerebral. Otros hongos que causan absceso cerebral en el huésped inmunocomprometido incluyen especies de Cándida, los hongos que provoca mucormicosis, Cladosporium trichoides, Curvularia spp., Fusarium, y otros. Las infecciones fúngicas del cerebro suelen dar lugar a múltiples abscesos cerebrales, y el pronóstico suele ser sombrío.
Parásitos
Los parásitos son la etiología más común del absceso cerebral en los Estados Unidos. La cisticercosis debida a la infección por Taenia solium causa el 85% de las infecciones cerebrales en la Ciudad de México. Otras especies de parásitos que pueden ocasionar absceso cerebral son Entamoeba histolytica, Schistosoma japonicum y especies de Paragonimus.
Cuadro Clínico del Absceso Cerebral
Las manifestaciones clínicas del absceso cerebral inicialmente tienden a ser inespecíficas, lo que provoca un retraso en el diagnóstico. El diagnóstico se realiza en promedio ocho días después del inicio de los síntomas. La cefalea es el síntoma más frecuente del absceso cerebral (69%). El dolor generalmente se localiza del lado del absceso y su inicio puede ser gradual o repentino. Suele ser intenso y no mejora a la administración de aspirina u otros analgésicos. En pacientes con cardiopatía cianótica y cefalea, siempre se debe excluir el absceso cerebral.
La rigidez de nuca ocurre en el 15% de los pacientes con absceso cerebral. Este síntoma se asocia más comúnmente a un absceso del lóbulo occipital o a un absceso que se ha filtrado hacia un ventrículo lateral. La alteración del estado mental (letargo que evoluciona a coma) es indicativo de edema cerebral grave y es dato de mal pronóstico. Los vómitos generalmente se desarrollan asociados a un aumento de la presión intracraneal.
Exploración Física
La fiebre es poco específica en el absceso cerebral ya que solo el 45 al 53% de los pacientes la presentan. Los déficits neurológicos focales se observan en el 50% de los pacientes posterior al inicio de la cefalea. Las convulsiones se desarrollan en el 25% de los casos y pueden ser la primera manifestación. Las convulsiones de tipo gran mal son particularmente comunes en los abscesos frontales. Los déficits del III y VI par craneal son indicativos de aumento de la presión intracraneal (atención a la exploración de los movimientos oculares).
El papiledema es una manifestación tardía de edema cerebral y generalmente demora varios días en desarrollarse. Este último hallazgo se observa en aproximadamente el 25% de los pacientes.
Estudios que serán de utilidad
Ante la presencia de síntomas focalizados como cefalea unilateral o signos (déficit unilateral de pares craneales, hemiparesia) o ante el hallazgo de papiledema, la punción lumbar está contraindicada. La descompresión del líquido cefalorraquídeo por debajo del tentorio, asociada a edema cerebral asimétrico, da como resultado herniación del tallo cerebral en 1.5 a 30 % de los casos.
Tomografía Axial Computarizada
No es tan sensible como la resonancia magnética para el diagnóstico de abscesos cerebrales, pero se puede obtener con mayor facilidad de forma emergente. Cuando se busca un absceso cerebral, este estudio se debe realizar contrastada. Se podrá observar:
- La cerebritis temprana aparece como un área irregular de baja densidad que no mejora después de la inyección de contraste.
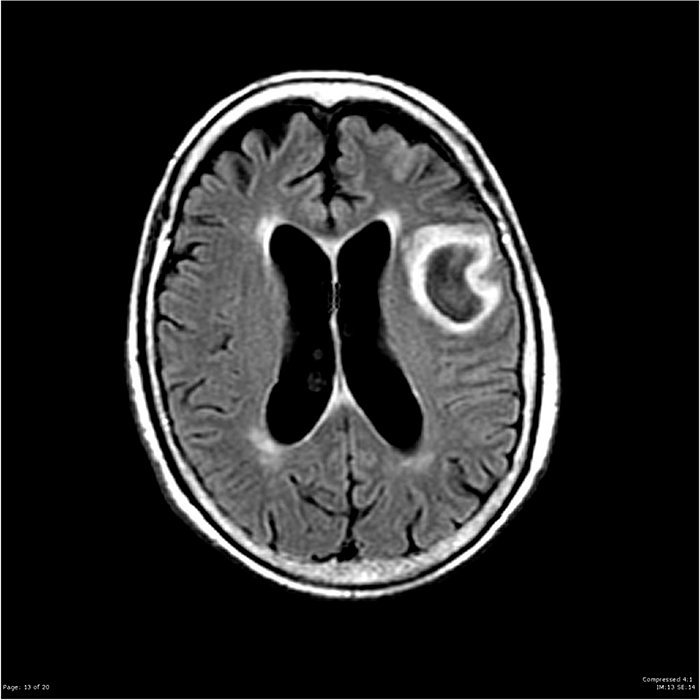
- A medida que evoluciona la cerebritis, la lesión se visualiza con un anillo difuso y grueso posterior a la inyección con contraste. El contraste en anillo representa la ruptura de la barrera hematoencefálica y el desarrollo de una cápsula inflamatoria.
- La imagen previa a contraste revela un área de mayor densidad en comparación al tejido circundante cuando la lesión ha madurado y ha sido encapsulada. El estudio con contraste en estas lesiones tardías muestra un anillo delgado, que puede ser de grosor irregular y a menudo menos prominente en la superficie medial o ventricular de la sustancia blanca profunda, donde la vascularidad se reduce.
Resonancia Magnética
La RM debe realizarse contrastada, al aumentar la intensidad en T1 y mejorar la visualización de lesiones en comparación con la TAC. Además, la RM en comparación con la tomografía computarizada:
- Es más sensible para detectar cerebritis temprana.
- Más sensible para detectar lesiones satélite.
- Estima de manera más precisa el grado de necrosis central, realce en anillo y edema cerebral.
- Mejor visualización del tallo cerebral.
La resonancia magnética con tensor de difusión es capaz de diferenciar las lesiones en anillo, secundarias a un absceso cerebral, de las lesiones neoplásicas. Los abscesos suelen ser hiperintensos (indicativo de difusión restringida, característica de los materiales viscosos, como la pus), mientras que las lesiones neoplásicas son hipointensas o muestran hiperintensidad variable y menor a la intensidad observada en un absceso.
Estudio Microbiológico
La evaluación microbiológica del LCR (punción lumbar contraindicada ante datos de hipertensión intracraneal), sangre o aspirado del absceso debe incluir tinción de Gram tanto para anaerobias como aerobias. En pacientes inmunocomprometidos y con factores de riesgo (p.e. antecedentes de tuberculosis pulmonar o infecciones oportunistas) deberás solicitar tinciones y cultivos para micobacterias (p.e. Löwenstein Jensen) , Nocardia y hongos, así como PCR para T. gondii (en VIH). Si tu sospecha es alta para un absceso bacteriano pero los cultivos fueron negativos, solicita secuenciación de ADN ribosomal 16S y amplificación por PCR para obtener el diagnóstico etiológico definitivo y proporcionar antibioticoterapia dirigida.
En raras ocasiones, los hallazgos en el LCR se asemejan a los de la meningitis bacteriana, y son indicativos de ruptura del absceso hacia el ventrículo. Cuando esto ocurre, el recuento de PMN puede ser mayor a 150,000/ml con hipoglucorraquia y proteínas elevadas. En pacientes con probable meningitis que responden mal a antibióticos se debe realizar una RM, lo que puede revelar un absceso cerebral insospechado que se ha roto hacia el ventrículo.
Serología
Realiza serología de la muestra de sangre y LCR en pacientes con riesgo de absceso cerebral parasitario. La detección de anticuerpos IgG anti-toxoplasma o anticicsticercos en sangre en muestras de LCR pueden ayudar en el diagnóstico de infecciones por Toxoplasma gondii y neurocisticercosis, respectivamente.
Histopatología
El diagnóstico definitivo de absceso cerebral y, con frecuencia, la identificación del agente etiológico, se realizan mediante examen histopatológico del tejido cerebral obtenido mediante biopsia cerebral abierta o estereotáctica.
Tratamiento Quirúrgico
El tratamiento neuroquirúrgico del absceso cerebral está indicado para la identificación del patógeno causante, si éste no se ha logrado identificar de otra manera, así como en pacientes selectos para la reducción del tamaño del absceso. Casi todo absceso cerebral de al menos 1 cm. de diámetro puede ser sujeto a aspiración estereotáctica independientemente de su localización. La aspiración estereotáctica del centro purulento del absceso está indicada con fines diagnósticos y de descompresión a menos de que esté contraindicada (patógeno del que se sospecha o condición clínica del paciente).
Si el absceso se localiza superficial y no se ubica en tejido cerebral elocuente (áreas del cerebro de importancia crítica para funciones tales como el habla, movimiento, sensibilidad o visión), se puede resecar en lugar de drenar. En especial cuando se sospecha de una infección tuberculosa, por actinomyces o nocardia. Si ya se logró identificar al patógeno, la indicación para aspiración dependerá de la localización y tamaño del absceso, así como de la probabilidad de lograr descompresión significativa.
Un absceso de más de 2.5 cm. de diámetro es por lo general indicativo de intervención neuroquirúrgica. En pacientes con múltiples abscesos cerebrales, el más grande deberá ser aspirado con fines diagnósticos. La decisión de aspirar los demás se debe realizar con base en su tamaño, el edema perilesional, la sintomatología del paciente y la respuesta a la antibioticoterapia. En caso de que el absceso ocasione efecto de masa con visualización de desplazamiento de la línea media y riesgo de herniación, estará indicada la intervención neuroquirúrgica independientemente del tamaño de la lesión. Si existe avulsión del absceso hacia el sistema ventricular sin ruptura, se debe valorar su drenaje para prevenir la ruptura y la consiguiente ventriculitis.
Tratamiento Farmacológico del Absceso Cerebral
Inicia tratamiento farmacológico empírico ante la sospecha de un absceso cerebral en tu paciente. La única excepción a esto será cuando neurocirugía pueda realizar la aspiración estereotáctica en un par de horas, el cuadro no sea grave y el paciente se encuentre estable. La elección de tratamiento dependerá de la sospecha etiológica y acorde a los factores de riesgo a los que ha estado expuesto el paciente. En pacientes postrasplantados indica una cefalosporina de tercera generación (ceftriaxona o cefotaxima) más metronidazol.
Si sospechas de infección por Nocardia utiliza cotrimoxazol o sulfadiazina, así como voriconazol en las infecciones fúngicas, en especial Aspergillus. Los pacientes VIH positivos deberán ser tratados para toxoplasmosis (pirimetamina más sulfadiazina) únicamente si presentan anticuerpos IgG positivos. Indica tratamiento para tuberculosis en pacientes con VIH y en quienes provengan de zonas endémicas y tengan factores de riesgo conocidos. Por otro lado, pacientes neuroquirúrgicos o con traumatismo craneoencefálico y fractura de cráneo indica vancomicina más una cefalosporina de tercera (ceftriaxona o cefotaxima) o cuarta generación (cefepima) y metronidazol.
Si la infección es secundaria a un foco parameníngeo sin antecedente de neurocirugía, el tratamiento empírico consiste en ceftriaxona o cefotaxima más metronidazol. Agrega vancomicina si hay sospecha de infección estafilocócica. Podrás usar Meropenem si existe alguna contraindicación para las cefalosporinas. En casos secundarios a diseminación hematógena, el tratamiento consiste en una cefalosporina de tercera generación más metronidazol; agregando vancomicina si sospechas de infección estafilocócica.
Toma en cuenta que…
27% de los abscesos cerebrales son polimicrobianos, por lo que se recomienda tratamiento de amplio espectro hasta conocer los resultados del cultivo del absceso, hemocultivos o cultivos de otros sitios de infección. Si la etiopatogenia es por contigüidad, deberás indicar antibióticos de amplio espectro aunque no se hayan aislado otros patógenos. En pacientes con traumatismo craneoencefálico complicado o neuroquirúrgicos se han descrito bacilos gramnegativos multirresistentes como agentes causantes.
El tratamiento antimicrobiano intravenoso deberás indicarlo por 6 a 8 semanas. El uso prolongado de metronidazol se ha asociado a neuropatía. Los criterios más importantes para evaluar la evolución de tu paciente son el estado neurológico y el tamaño del absceso en la imagen de cráneo. Solicita TAC contrastada de control inmediatamente si existe deterioro clínico de tu paciente o posterior a 1 o 2 semanas si no hay mejoría; cada 2 semanas hasta por 3 meses hasta que la mejoría sea evidente.
El paciente tendrá que ser intervenido de nuevo en caso de deterioro clínico con aumento del tamaño del absceso en la imagen de cráneo y a pesar del tratamiento antimicrobiano.
Referencias Bibliográficas
Brouwer MC, Tunkel AR, McKhann GM 2nd, van de Beek D. Brain abscess. N Engl J Med 2014; 371:447.
Chun CH, Johnson JD, Hofstetter M, Raff MJ. Brain abscess. A study of 45 consecutive cases. Medicine (Baltimore) 1986; 65:415.
Bakshi R, Wright PD, Kinkel PR, et al. Cranial magnetic resonance imaging findings in bacterial endocarditis: the neuroimaging spectrum of septic brain embolization demonstrated in twelve patients. J Neuroimaging 1999; 9:78.
Gallagher RM, Gross CW, Phillips CD. Suppurative intracranial complications of sinusitis. Laryngoscope 1998; 108:1635.
Giannoni C, Sulek M, Friedman EM. Intracranial complications of sinusitis: a pediatric series. Am J Rhinol 1998; 12:173.
Giannoni CM, Stewart MG, Alford EL. Intracranial complications of sinusitis. Laryngoscope 1997; 107:863.
Yen PT, Chan ST, Huang TS. Brain abscess: with special reference to otolaryngologic sources of infection. Otolaryngol Head Neck Surg 1995; 113:15.
Kangsanarak J, Fooanant S, Ruckphaopunt K, et al. Extracranial and intracranial complications of suppurative otitis media. Report of 102 cases. J Laryngol Otol 1993; 107:999.
Chalstrey S, Pfleiderer AG, Moffat DA. Persisting incidence and mortality of sinogenic cerebral abscess: a continuing reflection of late clinical diagnosis. J R Soc Med 1991; 84:193.
Foy P, Sharr M. Cerebral abscesses in children after pencil-tip injuries. Lancet 1980; 2:662.
Lew JF, Wiedermann BL, Sneed J, et al. Aerotolerant Clostridium tertium brain abscess following a lawn dart injury. J Clin Microbiol 1990; 28:2127.
Staecker H, Nadol JB Jr, Ojeman R, McKenna MJ. Delayed intracranial abscess after acoustic neuroma surgery: a report of two cases. Am J Otol 1999; 20:369.
Hashmi S, Jones RA. Delayed recurrence of cerebellar abscess 20 years after excision of dermoid cyst and sinus. Br J Neurosurg 1998; 12:358.
Fischer EG, Shwachman H, Wepsic JG. Brain abscess and cystic fibrosis. J Pediatr 1979; 95:385.
Patel KS, Marks PV. Multiple brain abscesses secondary to bronchiectasis. A case of 34 discrete abscesses in one brain. Clin Neurol Neurosurg 1989; 91:265.
Kum N, Charles D. Cerebral abscess associated with an intrauterine contraceptive device. Obstet Gynecol 1979; 54:375.
Schlaeffer F, Riesenberg K, Mikolich D, et al. Serious bacterial infections after endoscopic procedures. Arch Intern Med 1996; 156:572.
Takeshita M, Kagawa M, Yato S, et al. Current treatment of brain abscess in patients with congenital cyanotic heart disease. Neurosurgery 1997; 41:1270.
Cahill DP, Barker FG 2nd, Davis KR, et al. Case records of the Massachusetts General Hospital. Case 10-2010. A 37-year-old woman with weakness and a mass in the brain. N Engl J Med 2010; 362:1326.
Chiu HY, Lin SJ. Red papules on the tongue of a patient with hemiparesis. JAMA 2014; 312:741.
Boother EJ, Brownlow S, Tighe HC, et al. Cerebral Abscess Associated With Odontogenic Bacteremias, Hypoxemia, and Iron Loading in Immunocompetent Patients With Right-to-Left Shunting Through Pulmonary Arteriovenous Malformations. Clin Infect Dis 2017; 65:595.
Schliamser SE, Bäckman K, Norrby SR. Intracranial abscesses in adults: an analysis of 54 consecutive cases. Scand J Infect Dis 1988; 20:1.
Ng PY, Seow WT, Ong PL. Brain abscesses: review of 30 cases treated with surgery. Aust N Z J Surg 1995; 65:664.
Yang SY, Zhao CS. Review of 140 patients with brain abscess. Surg Neurol 1993; 39:290.
Nielsen H, Gyldensted C, Harmsen A. Cerebral abscess. Aetiology and pathogenesis, symptoms, diagnosis and treatment. A review of 200 cases from 1935-1976. Acta Neurol Scand 1982; 65:609.
Badger JL, Stins MF, Kim KS. Citrobacter freundii invades and replicates in human brain microvascular endothelial cells. Infect Immun 1999; 67:4208.
Britt RH, Enzmann DR. Clinical stages of human brain abscesses on serial CT scans after contrast infusion. Computerized tomographic, neuropathological, and clinical correlations. J Neurosurg 1983; 59:972.
Brouwer MC, Coutinho JM, van de Beek D. Clinical characteristics and outcome of brain abscess: systematic review and meta-analysis. Neurology 2014; 82:806.
Bonvin P, Ejlertsen T, Dons-Jensen H. Brain abscess caused by Salmonella enteritidis in an immunocompetent adult patient: successful treatment with cefotaxime and ciprofloxacin. Scand J Infect Dis 1998; 30:632.
Yamamoto M, Fukushima T, Ohshiro S, et al. Brain abscess caused by Streptococcus intermedius: two case reports. Surg Neurol 1999; 51:219.
Grigoriadis E, Gold WL. Pyogenic brain abscess caused by Streptococcus pneumoniae: case report and review. Clin Infect Dis 1997; 25:1108.
Bañuelos AF, Williams PL, Johnson RH, et al. Central nervous system abscesses due to Coccidioides species. Clin Infect Dis 1996; 22:240.
Ohnishi K, Murata M, Kojima H, et al. Brain abscess due to infection with Entamoeba histolytica. Am J Trop Med Hyg 1994; 51:180.
Lakshmi V, Rao RR, Dinakar I. Bacteriology of brain abscess–observations on 50 cases. J Med Microbiol 1993; 38:187.
Brook I. Aerobic and anaerobic bacteriology of intracranial abscesses. Pediatr Neurol 1992; 8:210.
Hagensee ME, Bauwens JE, Kjos B, Bowden RA. Brain abscess following marrow transplantation: experience at the Fred Hutchinson Cancer Research Center, 1984-1992. Clin Infect Dis 1994; 19:402.
Baddley JW, Salzman D, Pappas PG. Fungal brain abscess in transplant recipients: epidemiologic, microbiologic, and clinical features. Clin Transplant 2002; 16:419.
Friedlander RM, Gonzalez RG, Afridi NA, Pfannl R. Case records of the Massachusetts General Hospital. Weekly clinicopathological exercises. Case 16-2003. A 58-year-old woman with left-sided weakness and a right frontal brain mass. N Engl J Med 2003; 348:2125.
Arlotti M, Grossi P, Pea F, et al. Consensus document on controversial issues for the treatment of infections of the central nervous system: bacterial brain abscesses. Int J Infect Dis 2010; 14 Suppl 4:S79.
Le Moal G, Landron C, Grollier G, et al. Characteristics of brain abscess with isolation of anaerobic bacteria. Scand J Infect Dis 2003; 35:318.
Drancourt M, Nkamga VD, Lakhe NA, et al. Evidence of Archaeal Methanogens in Brain Abscess. Clin Infect Dis 2017; 65:1.
Sifri CD, Park J, Helm GA, et al. Fatal brain abscess due to community-associated methicillin-resistant Staphylococcus aureus strain USA300. Clin Infect Dis 2007; 45:e113.
Jacobs JA, Pietersen HG, Stobberingh EE, Soeters PB. Bacteremia involving the “Streptococcus milleri” group: analysis of 19 cases. Clin Infect Dis 1994; 19:704.
Corne P, Rajeebally I, Jonquet O. Rhodococcus equi brain abscess in an immunocompetent patient. Scand J Infect Dis 2002; 34:300.
Brook I. Brain abscess in children: microbiology and management. J Child Neurol 1995; 10:283.
Rau CS, Chang WN, Lin YC, et al. Brain abscess caused by aerobic Gram-negative bacilli: clinical features and therapeutic outcomes. Clin Neurol Neurosurg 2002; 105:60.
Guppy KH, Thomas C, Thomas K, Anderson D. Cerebral fungal infections in the immunocompromised host: a literature review and a new pathogen–Chaetomium atrobrunneum: case report. Neurosurgery 1998; 43:1463.
Eckburg PB, Montoya JG, Vosti KL. Brain abscess due to Listeria monocytogenes: five cases and a review of the literature. Medicine (Baltimore) 2001; 80:223.
Cone LA, Leung MM, Byrd RG, et al. Multiple cerebral abscesses because of Listeria monocytogenes: three case reports and a literature review of supratentorial listerial brain abscess(es). Surg Neurol 2003; 59:320.
Valarezo J, Cohen JE, Valarezo L, et al. Nocardial cerebral abscess: report of three cases and review of the current neurosurgical management. Neurol Res 2003; 25:27.
Erdogan E, Beyzadeoglu M, Arpaci F, Celasun B. Cerebellar aspergillosis: case report and literature review. Neurosurgery 2002; 50:874.
Garcia RR, Min Z, Narasimhan S, Bhanot N. Fusarium brain abscess: case report and literature review. Mycoses 2015; 58:22.
Correa D, Sarti E, Tapia-Romero R, et al. Antigens and antibodies in sera from human cases of epilepsy or taeniasis from an area of Mexico where Taenia solium cysticercosis is endemic. Ann Trop Med Parasitol 1999; 93:69.
Seydoux C, Francioli P. Bacterial brain abscesses: factors influencing mortality and sequelae. Clin Infect Dis 1992; 15:394.
Heilpern KL, Lorber B. Focal intracranial infections. Infect Dis Clin North Am 1996; 10:879.
Nielsen H. Cerebral abscess in children. Neuropediatrics 1983; 14:76.
Patir R, Sood S, Bhatia R. Post-traumatic brain abscess: experience of 36 patients. Br J Neurosurg 1995; 9:29.
Tattevin P, Bruneel F, Clair B, et al. Bacterial brain abscesses: a retrospective study of 94 patients admitted to an intensive care unit (1980 to 1999). Am J Med 2003; 115:143.
Leuthardt EC, Wippold FJ 2nd, Oswood MC, Rich KM. Diffusion-weighted MR imaging in the preoperative assessment of brain abscesses. Surg Neurol 2002; 58:395.
Ferré C, Ariza J, Viladrich PF, et al. Brain abscess rupturing into the ventricles or subarachnoid space. Am J Med 1999; 106:254.
Kamra P, Vatsal DK, Husain M, et al. MRI demonstration of unsuspected intraventricular rupture of pyogenic cerebral abscesses in patients being treated for meningitis. Neuroradiology 2002; 44:114.
Al Masalma M, Armougom F, Scheld WM, et al. The expansion of the microbiological spectrum of brain abscesses with use of multiple 16S ribosomal DNA sequencing. Clin Infect Dis 2009; 48:1169.
Keller PM, Rampini SK, Bloemberg GV. Detection of a mixed infection in a culture-negative brain abscess by broad-spectrum bacterial 16S rRNA gene PCR. J Clin Microbiol 2010; 48:2250.
Al Masalma M, Lonjon M, Richet H, et al. Metagenomic analysis of brain abscesses identifies specific bacterial associations. Clin Infect Dis 2012; 54:202.
DiGiulio DB, Relman DA. Majority rules? Tallying the microbial census in an abscess by means of molecular methods. Clin Infect Dis 2009; 48:1179.
Cavuşoglu H, Kaya RA, Türkmenoglu ON, et al. Brain abscess: analysis of results in a series of 51 patients with a combined surgical and medical approach during an 11-year period. Neurosurg Focus 2008; 24:E9.
Arlotti M, Grossi P, Pea F, et al. Consensus document on controversial issues for the treatment of infections of the central nervous system: bacterial brain abscesses. Int J Infect Dis 2010; 14 Suppl 4:S79.
Brouwer MC, Tunkel AR, McKhann GM 2nd, van de Beek D. Brain abscess. N Engl J Med 2014; 371:447.
Sonneville R, Ruimy R, Benzonana N, et al. An update on bacterial brain abscess in immunocompetent patients. Clin Microbiol Infect 2017; 23:614.
Martin-Canal G, Saavedra A, Asensi JM, et al. Meropenem monotherapy is as effective as and safer than imipenem to treat brain abscesses. Int J Antimicrob Agents 2010; 35:301.
Baddour LM, Wilson WR, Bayer AS, et al. Infective Endocarditis in Adults: Diagnosis, Antimicrobial Therapy, and Management of Complications: A Scientific Statement for Healthcare Professionals From the American Heart Association. Circulation 2015; 132:1435.
Tunkel AR, Hartman BJ, Kaplan SL, et al. Practice guidelines for the management of bacterial meningitis. Clin Infect Dis 2004; 39:1267.
Liu C, Bayer A, Cosgrove SE, et al. Clinical practice guidelines by the infectious diseases society of america for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Clin Infect Dis 2011; 52:e18.
Pfausler B, Spiss H, Beer R, et al. Treatment of staphylococcal ventriculitis associated with external cerebrospinal fluid drains: a prospective randomized trial of intravenous compared with intraventricular vancomycin therapy. J Neurosurg 2003; 98:1040.
Jorgenson L, Reiter PD, Freeman JE, et al. Vancomycin disposition and penetration into ventricular fluid of the central nervous system following intravenous therapy in patients with cerebrospinal devices. Pediatr Neurosurg 2007; 43:449.
Wang Q, Shi Z, Wang J, et al. Postoperatively administered vancomycin reaches therapeutic concentration in the cerebral spinal fluid of neurosurgical patients. Surg Neurol 2008; 69:126.
Nau R, Prange HW, Menck S, et al. Penetration of rifampicin into the cerebrospinal fluid of adults with uninflamed meninges. J Antimicrob Chemother 1992; 29:719.
Perlroth J, Kuo M, Tan J, et al. Adjunctive use of rifampin for the treatment of Staphylococcus aureus infections: a systematic review of the literature. Arch Intern Med 2008; 168:805.
von Specht M, Gardella N, Tagliaferri P, et al. Methicillin-resistant Staphylococcus aureus in community-acquired meningitis. Eur J Clin Microbiol Infect Dis 2006; 25:267.
Pintado V, Meseguer MA, Fortún J, et al. Clinical study of 44 cases of Staphylococcus aureus meningitis. Eur J Clin Microbiol Infect Dis 2002; 21:864.
Kessler AT, Kourtis AP. Treatment of meningitis caused by methicillin-resistant Staphylococcus aureus with linezolid. Infection 2007; 35:271.
Naesens R, Ronsyn M, Druwé P, et al. Central nervous system invasion by community-acquired meticillin-resistant Staphylococcus aureus. J Med Microbiol 2009; 58:1247.
Ntziora F, Falagas ME. Linezolid for the treatment of patients with central nervous system infection. Ann Pharmacother 2007; 41:296.
Saito N, Aoki K, Sakurai T, et al. Linezolid treatment for intracranial abscesses caused by methicillin-resistant Staphylococcus aureus–two case reports. Neurol Med Chir (Tokyo) 2010; 50:515.
Levitz RE, Quintiliani R. Trimethoprim-sulfamethoxazole for bacterial meningitis. Ann Intern Med 1984; 100:881.
Vartzelis G, Theodoridou M, Daikos GL, et al. Brain abscesses complicating Staphylococcus aureus sepsis in a premature infant. Infection 2005; 33:36.
Lee DH, Palermo B, Chowdhury M. Successful treatment of methicillin-resistant staphylococcus aureus meningitis with daptomycin. Clin Infect Dis 2008; 47:588.
Wallace WR, Sander AW, Licitra C, et al. Methicillin-resistant Staphylococcus aureus meningitis successfully treated with daptomycin. Infect Dis Clin North Am 2009; 17:69.
Helweg-Larsen J, Astradsson A, Richhall H, et al. Pyogenic brain abscess, a 15 year survey. BMC Infect Dis 2012; 12:332.
Infection in Neurosurgery Working Party of the British Society for Antimicrobial Chemotherapy. The rational use of antibiotics in the treatment of brain abscess. Br J Neurosurg 2000; 14:525.
Sharma R, Mohandas K, Cooke RP. Intracranial abscesses: changes in epidemiology and management over five decades in Merseyside. Infection 2009; 37:39.
Ratnaike TE, Das S, Gregson BA, Mendelow AD. A review of brain abscess surgical treatment–78 years: aspiration versus excision. World Neurosurg 2011; 76:431.
Meng XH, Feng SY, Chen XL, et al. Minimally invasive image-guided keyhole aspiration of cerebral abscesses. Int J Clin Exp Med 2015; 8:155.
Neidert MC, Karlin K, Actor B, et al. Preoperative C-reactive protein predicts the need for repeated intracerebral brain abscess drainage. Clin Neurol Neurosurg 2015; 131:26.
Carpenter JL. Brain stem abscesses: cure with medical therapy, case report, and review. Clin Infect Dis 1994; 18:219.
Ng PY, Seow WT, Ong PL. Brain abscesses: review of 30 cases treated with surgery. Aust N Z J Surg 1995; 65:664.
Su TM, Lan CM, Tsai YD, et al. Multiloculated pyogenic brain abscess: experience in 25 patients. Neurosurgery 2008; 62 Suppl 2:556.
Mampalam TJ, Rosenblum ML. Trends in the management of bacterial brain abscesses: a review of 102 cases over 17 years. Neurosurgery 1988; 23:451.
Zhai Y, Wei X, Chen R, et al. Surgical outcome of encapsulated brain abscess in superficial non-eloquent area: A systematic review. Br J Neurosurg 2016; 30:29.
Quartey GR, Johnston JA, Rozdilsky B. Decadron in the treatment of cerebral abscess. An experimental study. J Neurosurg 1976; 45:301.
Brouwer MC, Coutinho JM, van de Beek D. Clinical characteristics and outcome of brain abscess: systematic review and meta-analysis. Neurology 2014; 82:806.
Seydoux C, Francioli P. Bacterial brain abscesses: factors influencing mortality and sequelae. Clin Infect Dis 1992; 15:394.





