Parálisis Braquial del Recién Nacido: Revisión del Diagnóstico y Manejo.

La primera descripción clínica de la parálisis braquial del recién nacido se realizó en la década de 1760. A fines del siglo XIX, se definieron los diferentes tipos de esta entidad. Revisamos a continuación las claves sobre el diagnóstico y manejo de esta entidad.
Duchenne y Erb, en informes separados, describieron la lesión nerviosa del tronco superior en las raíces nerviosas C5 y C6, ahora llamada parálisis de Erb o parálisis de Erb-Duchenne, y Klumpke describió la lesión del tronco inferior que involucra las raíces nerviosas C8 y T1. Posteriormente, se reportó la parálisis de todas las raíces nerviosas desde C5 a T1.
Etiología de la Parálisis Braquial en Recién Nacidos
Los principales mecanismos de la parálisis braquial del recién nacido incluyen estiramiento y/o tracción, así como compresión. De estos, el estiramiento es considerado el mecanismo más común. Además, el estiramiento puede contribuir a la lesión del plexo braquial en los casos en que la principal causa sea uno de los otros mecanismos. La etiología de la parálisis braquial neonatal se ha atribuido tradicionalmente a la tracción lateral iatrogénica en la cabeza fetal, generalmente cuando la distocia de hombros impide el parto.
La tracción lateral hacia abajo (es decir, doblar el cuello del hombro anterior hacia el posterior) provoca un aumento del estiramiento del plexo braquial en comparación con la tracción axial (es decir, aplicar una fuerza paralela a la columna vertebral fetal). Sin embargo, la parálisis braquial puede ocurrir incluso cuando la tracción axial se aplica correctamente. La parálisis braquial después del nacimiento no indica en automático que el médico haya aplicado fuerza o maniobras que causaron la lesión nerviosa.
La fuerza de la contracción uterina y el empuje materno son probablemente suficientes para causar una tracción excesiva en el plexo braquial. Además, los factores previos al parto pueden predisponer a la lesión del plexo braquial, incluidas las anomalías uterinas, como las de Müller y las fibroides, que pueden provocar una mala posición y compresión fetal. Además, muchos casos de parálisis braquial ocurren independientemente de la distocia de hombros o de una fuerza excesiva por parte del médico.
Tipo de Lesiones
Las lesiones de los nervios periféricos se pueden clasificar como neurapráxicas, axonotméticas y neurotméticas, según la gravedad y el alcance de las lesiones de los componentes estructurales del nervio periférico, incluidas las células de Schwann, los axones y el tejido conectivo circundante.
Si bien es potencialmente útil para el pronóstico, no existe un estándar de oro para diferenciar estos tipos de lesiones en la parálisis braquial del recién nacido. El método más confiable es probablemente la exploración quirúrgica, que generalmente se realiza únicamente en pacientes seleccionados que tienen una pobre recuperación espontánea entre los tres y nueve meses de edad y, por tanto, pueden beneficiarse de la reparación de los nervios.
Los estudios de electrodiagnóstico y neuroimagen mediante resonancia magnética o mielografía tomográfica computarizada pueden identificar algunos casos de avulsión de la raíz nerviosa (neurotmesis), pero no se han considerado lo suficientemente confiables para fines de pronóstico en los primeros meses de vida. Por tanto, el pronóstico en la mayoría de los casos de parálisis braquial del recién nacido se estima con base en los criterios clínicos.
Neurapraxia
Generalmente es causada por una lesión leve (p. Ej., Isquemia, compresión mecánica, factores metabólicos o tóxicos) que produce desmielinización focal, pero no pérdida de la integridad axonal en la región de la lesión. Este tipo de lesión típicamente tiene un pronóstico favorable para la recuperación.
Axonotmesis
Ocurre como resultado de lesiones por aplastamiento, lesiones por estiramiento nervioso o por percusión. El axón y la vaina de mielina están localmente dañados de manera irreversible. Sin embargo, el estroma circundante, incluido el endoneuro y el perineuro, permanece intacto. El potencial de recuperación es intermedio.
Neurotmesis
Sucede con mayor frecuencia en asociación con lesiones graves. El axón, la vaina de mielina y el estroma circundante están dañados irreversiblemente. La continuidad externa del nervio lesionado generalmente se interrumpe (por ejemplo, en la avulsión de la raíz nerviosa). No se produce una regeneración importante en dicha lesión a menos que se realice una reparación quirúrgica.
Factores de riesgo
El único factor de riesgo establecido para la parálisis braquial del recién nacido es la distocia de hombros. Otros posibles factores de riesgo incluyen: aumento importante de peso materno, diabetes materna, multiparidad, macrosomía fetal y/o peso elevado al nacer, malposición fetal, inducción del parto, anomalías del parto, parto vaginal instrumentado y embarazo previo complicado por distocia de hombro o parálisis braquial del recién nacido. Sin embargo, ninguno de estos factores ha demostrado un valor predictivo consistente y estadísticamente significativo para la aparición de la parálisis braquial del recién nacido.
Prevención
No hay medidas comprobadas para predecir o prevenir la parálisis braquial del recién nacido. La aparición de la distocia de hombros en sí no se puede predecir con precisión sobre la base de factores de riesgo prenatales o anomalías del trabajo de parto. Por tanto, los médicos debemos estar preparados para una posible distocia de hombros en todos los partos vaginales y ser conscientes de los diversos procedimientos que han demostrado ser efectivos para manejar dicha distocia.
A pesar de la falta de intervenciones comprobadas para prevenir la parálisis braquial del recién nacido, existen varias situaciones clínicas en las que el Colegio Americano de Obstetras y Ginecólogos sugiere que consideremos una modificación del manejo obstétrico habitual:
- Sospecha de macrosomía fetal con un peso fetal estimado > 5000 gr. en mujeres no diabéticas o > 4500 gr. en mujeres diabéticas.
- Distocia de hombro previamente reconocida, especialmente cuando se asocia con una lesión neonatal grave.
- Parto vaginal instrumentado con un peso fetal al nacer > 4000 gr.
Presentación Clínica
La mayoría de los casos de parálisis braquial del recién nacido son unilaterales. La participación bilateral ocurre en aproximadamente el 5% de los casos. Se han descrito cinco patrones diferentes de afectación nerviosa:
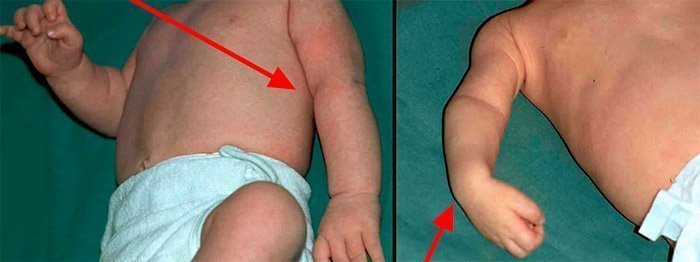
- Las lesiones de C5 y C6 (parálisis de Erb) representan aproximadamente el 50% de los casos. La debilidad involucra los músculos deltoides, infraespinosos (principalmente C5) y bíceps (principalmente C6). Como resultado, la parte superior del brazo se aduce y se gira internamente, y el antebrazo se extiende, mientras se preservan los movimientos de la mano y la muñeca.
- La lesión C5, C6 y C7 (parálisis de Erb Plus) representa aproximadamente el 35% de los casos y se manifiesta como aducción y rotación interna del brazo, extensión y pronación del antebrazo y flexión de las muñecas y los dedos, a veces denominada como postura de “propina del mesero”.
- La lesión de C5 a T1 por lo general se presenta con parálisis del brazo y algo de pérdida de flexión de los dedos.
- El daño grave a todas las raíces C5 a T1 se caracteriza por un brazo flácido y síndrome de Horner.
- La lesión C8 y T1 (verdadera parálisis de Klumpke) es el patrón más infrecuente y se manifiesta como parálisis aislada de la mano y síndrome de Horner.
En la práctica, la parálisis braquial del recién nacido se puede dividir en la parálisis común del plexo braquial superior que involucra lesiones en C5, C6 y, ocasionalmente, C7 (parálisis de Erb) y la parálisis total menos frecuente en el plexo braquial que involucra a todas las raíces de C5 a T1, que a menudo se llama erróneamente Parálisis de Klumpke. Algunos han cuestionado si la verdadera parálisis de Klumpke (es decir, la lesión de la raíz C8 y T1 con debilidad del brazo distal únicamente) ocurre en lo absoluto en el período neonatal.
Las lesiones asociadas a la parálisis braquial del recién nacido incluyen fracturas de clavícula y húmero, subluxación del hombro, subluxación de la columna cervical, lesión de la médula espinal cervical y parálisis facial. Estas ocurren en ≤ 10% de los casos. La afectación del nervio frénico (derivado de C3, C4 y C5) con parálisis diafragmática acompaña a una minoría de casos de parálisis del plexo superior (de Erb).
Diagnóstico
El diagnóstico de la parálisis braquial del recién nacido se realiza mediante el hallazgo de debilidad del brazo al nacer ( con sus posturas clásicas) y distribución compatible con lesión del plexo braquial. En muchos casos, el diagnóstico es sencillo. Sin embargo, determinar el patrón de debilidad en los neonatos puede ser difícil, en parte porque los neonatos normales tienden a movimientos relativamente limitados del brazo justo después del parto.
El diagnóstico inicial se basa en la realización de una historia clínica completa con antecedentes familiares, maternos y perinatales. El niño debe ser evaluado mediante exploración física, y estudios radiográficos para detectar fracturas o cualquier otra lesión asociada. El examen neurológico debe incluir la observación de movimientos espontáneos, rango de movimiento pasivo y activo, respuestas motoras y sensoriales estimuladas y evaluación de los reflejos para buscar signos de déficit neurológicos focales o globales.
- Ciertas posturas (p. Ej., la “propina del mesero”) están asociadas con lesiones particulares de la parálisis braquial.
- Un reflejo de Moro asimétrico es sugerente del diagnóstico.
- La ptosis y miosis (síndrome de Horner) apuntan a una afectación menor del plexo.
- La expansión asimétrica de la cavidad torácica y la falta de oxigenación o alimentación sugieren parálisis braquial del recién nacido asociada a parálisis diafragmática secundaria a lesión del nervio frénico (C3, C4, C5).
- La presencia temprana de rango de movimiento pasivo restringido sugiere que la lesión del nervio periférico ocurrió en el útero o que es secundaria a otra afección musculoesquelética, ya que las contracturas y las subluxaciones articulares se desarrollarán varios meses después de la lesión nerviosa.
- La hemiparesia o los déficits neurológicos globales hacen sospechar una etiología del sistema nervioso central.
Los exámenes diagnósticos que pueden ser de utilidad para las decisiones sobre el manejo y necesidad de reparación o reconstrucción del nervio incluyen estudios de electrodiagnóstico y neuroimagen. Debido al impacto potencial en el pronóstico y los problemas médico-legales, debemos tratar de determinar el momento en el que ocurrió la lesión del plexo braquial.
Inicio de la Parálisis
Para estimar el tiempo de inicio de la lesión del plexo braquial, se deben registrar los eventos previos al parto, la posición fetal, el sitio de lesión del plexo braquial, la relación anatómica del plexo braquial afectado con respecto al hombro anterior en el momento del parto, hematomas en el neonato, lesiones asociadas (p. ej., fracturas óseas), caput succedaneum, puntajes de Apgar y resultados de gasometría en la sangre del cordón umbilical.
Las lesiones del plexo braquial que ocurrieron mucho antes del parto pueden tener hallazgos asociados específicos relacionados con el brazo afectado, como atrofia de los músculos de la mano y el brazo y músculo pectoral mayor, contracturas articulares y desmineralización ósea.
Estudios electrodiagnósticos
Los estudios de electrodiagnóstico (electromiografía y estudios de conducción nerviosa) pueden ayudar a determinar la localización y la gravedad de la lesión nerviosa asociada a la parálisis braquial. Sin embargo, no existe un papel clínico claramente establecido para los estudios de electrodiagnóstico en la determinación de la etiología, el momento de la lesión o el pronóstico, aunque persiste la controversia sobre estos temas.
Neuroimagen
La RM de la médula espinal cervical puede detectar evidencia de avulsión de la raíz nerviosa proximal, es decir, una lesión neurotmética con mal pronóstico si no se trata; como lo sugiere el hallazgo de un pseudomeningocele (meningocele traumático) o un neuroma postraumático (una proliferación desorganizada de regeneración axonal, células de Schwann, y células perineurales). Aunque hay algunas variaciones, la mayoría de los estudios sugieren que tanto la resonancia magnética (RM) como la tomografía computarizada (TAC) tienen una sensibilidad de baja a moderada y una alta especificidad para la detección de pseudomeningocele.
Además, un informe encontró que la RM tenía una alta sensibilidad y especificidad para la detección de neuroma postraumático, pero no fue útil para la localización anatómica precisa al nivel del tronco del plexo braquial o el nivel de división. Dado que la TAC requiere una punción lumbar para introducir el contraste y expone al infante a radiación ionizante, cada vez se prefiere más la RM sobre la TAC para la evaluación de la parálisis braquial del recién nacido.
Manejo de la Parálisis Braquial del Recién Nacido
El manejo de la parálisis braquial del recién nacido es controvertido, un problema que se agrava por la falta de indicadores pronósticos. A menudo se emplea un período de terapia física y observación esperando evidencia de recuperación. Como se explica a continuación, se recomienda la intervención quirúrgica en casos seleccionados si la recuperación funcional no se produce en tres a nueve meses, pero no hay consenso con respecto a la utilidad o el momento de la cirugía.
Algunos bebés con deterioro moderado a grave pueden beneficiarse de la liberación de la contractura y la cirugía de transferencia muscular realizada entre los 18 y los 24 meses de edad. La referencia temprana a un centro con experiencia en el manejo de esta patología puede mejorar los resultados.
Terapia física
El manejo inicial de la parálisis braquial del recién nacido incluye medidas diseñadas para prevenir las contracturas, que incluyen ejercicios pasivos de rango de movimiento en todas las articulaciones relevantes, a partir de la segunda mitad de la primera semana después del nacimiento, férulas de apoyo según sea necesario para prevenir la flexión de los dedos o las contracturas del codo y promoción del fortalecimiento muscular y función normales.
Cirugía
La intervención quirúrgica de la parálisis braquial del recién nacido se recomienda en casos seleccionados con lesión nerviosa grave, o si la recuperación funcional no se produce en tres a nueve meses, pero no hay consenso con respecto a la utilidad o el momento de la cirugía. El problema se ve agravado por la falta de estudios prospectivos multicéntricos y ensayos aleatorizados. En varias revisiones e informes, las indicaciones para la reparación o reconstrucción del nervio quirúrgico incluyen lo siguiente:
- Panplexopatía y lesiones de las raíces preganglionares.
- Lesiones neurotméticas o avulsiones de la raíz nerviosa.
- Recuperación funcional incompleta:
- Ausencia de flexión activa del codo a los tres meses de edad.
- Función de la mano ausente o gravemente dañada a los tres meses en un bebé con un brazo inestable al nacer.
- Incapacidad del lactante para llevar una galleta a la boca con la extremidad afectada a los nueve meses (prueba de la galleta).
- Incapacidad del bebé para usar la extremidad afectada para quitar una toalla que cubre la cara a los seis meses (prueba de la toalla).
- Función de la mano razonablemente buena pero con un déficit persistente de extensión activa de la muñeca, elevación débil del hombro y rotación externa del hombro ausente a los seis meses.
Como regla general, las lesiones C8-T1 (Klumpke) reducen la probabilidad de que la cirugía restablezca la función útil de la mano. Las transferencias nerviosas de los nervios intercostales o los fascículos motores cubitales al nervio musculocutáneo pueden restaurar la flexión del codo. La cirugía de reconstrucción secundaria de tejido blando del hombro para corregir la contractura de la rotación interna puede mejorar aún más la función.
Pronóstico de la Parálisis Braquial del Recién Nacido
La historia natural de la parálisis braquial del recién nacido no está definida con precisión. La recuperación espontánea ocurre durante uno a tres meses en muchos, si no es que en la mayoría de los casos. Sin embargo, se observa un deterioro funcional persistente en 18 a 50% de los pacientes. La lesión inicial extensa asociada con la parálisis total del plexo braquial (panplexopatía) apunta a un resultado menos favorable en comparación con la parálisis del plexo braquial superior (Erb). En varios estudios, los indicadores de pronóstico favorable incluyeron lo siguiente:
- Mejoría clínica temprana (es decir, inicio de la recuperación dentro de dos a cuatro semanas).
- Flexión del codo a los tres meses de edad.
- Fuerza normal o casi normal en la flexión del codo, la rotación externa del hombro y la supinación del antebrazo a los tres meses de edad.
- Recuperación de la fuerza en los bíceps, tríceps y músculos deltoides a los 4.5 meses.
En contraste, la ausencia de mejoría espontánea a lo largo del tiempo se asocia con un potencial decreciente de recuperación.
Referencias Bibliográficas
Pondaag W, Gert van Dijk J, Malessy MJ. Obstetric brachial plexus palsy. Dev Med Child Neurol 2010; 52:502.
Alfonso DT. Causes of neonatal brachial plexus palsy. Bull NYU Hosp Jt Dis 2011; 69:11.
Ferrante MA. Brachial plexopathies: classification, causes, and consequences. Muscle Nerve 2004; 30:547.
Wilbourn AJ. Plexopathies. Neurol Clin 2007; 25:139.
Foad SL, Mehlman CT, Ying J. The epidemiology of neonatal brachial plexus palsy in the United States. J Bone Joint Surg Am 2008; 90:1258.
Malessy MJ, Pondaag W, van Dijk JG. Electromyography, nerve action potential, and compound motor action potentials in obstetric brachial plexus lesions: validation in the absence of a “gold standard”. Neurosurgery 2009; 65:A153.
Kay SP. Obstetrical brachial palsy. Br J Plast Surg 1998; 51:43.
van Dijk JG, Pondaag W, Malessy MJ. Obstetric lesions of the brachial plexus. Muscle Nerve 2001; 24:1451.
Dawodu A, Sankaran-Kutty M, Rajan TV. Risk factors and prognosis for brachial plexus injury and clavicular fracture in neonates: a prospective analysis from the United Arab Emirates. Ann Trop Paediatr 1997; 17:195.
The American College of Obstetricians and Gynecologists Task Force on Neonatal Brachial Plexus Palsy. Incidence of neonatal brachial plexus palsy. In: Neonatal Brachial Plexus Palsy, Washington, D.C. 2014. p.1.
The American College of Obstetricians and Gynecologists Task Force on Neonatal Brachial Plexus Palsy. Neonatal brachial plexus palsy and shoulder dystocia. In: Neonatal Brachial Plexus Palsy, Washington, D.C. 2014. p.41.
Gurewitsch ED, Johnson E, Hamzehzadeh S, Allen RH. Risk factors for brachial plexus injury with and without shoulder dystocia. Am J Obstet Gynecol 2006; 194:486.
Levine MG, Holroyde J, Woods JR Jr, et al. Birth trauma: incidence and predisposing factors. Obstet Gynecol 1984; 63:792.
Grossman JA. Early operative intervention for birth injuries to the brachial plexus. Semin Pediatr Neurol 2000; 7:36.
Lin H, Hou C, Chen D. Modified C7 neurotization for the treatment of obstetrical brachial plexus palsy. Muscle Nerve 2010; 42:764.
Louden EJ, Broering CA, Mehlman CT, et al. Meta-analysis of function after secondary shoulder surgery in neonatal brachial plexus palsy. J Pediatr Orthop 2013; 33:656.
Grossman JA. Early operative intervention for selected cases of brachial plexus birth injury. Arch Neurol 2006; 63:1031.
Sparagana SP, Ezaki M. Microneurosurgery for neonatal brachial plexus palsy: The need for more information. Arch Neurol 2006; 63:1033.
The American College of Obstetricians and Gynecologists Task Force on Neonatal Brachial Plexus Palsy. Patterns of neonatal brachial plexus palsy and outcomes. In: Neonatal Brachial Plexus Palsy, Washington, D.C. 2014. p.65.
Marcus JR, Clarke HM. Management of obstetrical brachial plexus palsy evaluation, prognosis, and primary surgical treatment. Clin Plast Surg 2003; 30:289.
Curtis C, Stephens D, Clarke HM, Andrews D. The active movement scale: an evaluative tool for infants with obstetrical brachial plexus palsy. J Hand Surg Am 2002; 27:470.
Bertelli JA, Ghizoni MF. The towel test: a useful technique for the clinical and electromyographic evaluation of obstetric brachial plexus palsy. J Hand Surg Br 2004; 29:155.
Shenaq SM, Bullocks JM, Dhillon G, et al. Management of infant brachial plexus injuries. Clin Plast Surg 2005; 32:79.
Gilbert A, Pivato G, Kheiralla T. Long-term results of primary repair of brachial plexus lesions in children. Microsurgery 2006; 26:334.
Birch R, Ahad N, Kono H, Smith S. Repair of obstetric brachial plexus palsy: results in 100 children. J Bone Joint Surg Br 2005; 87:1089.
Haerle M, Gilbert A. Management of complete obstetric brachial plexus lesions. J Pediatr Orthop 2004; 24:194.
Kawabata H, Shibata T, Matsui Y, Yasui N. Use of intercostal nerves for neurotization of the musculocutaneous nerve in infants with birth-related brachial plexus palsy. J Neurosurg 2001; 94:386.
El-Gammal TA, Abdel-Latif MM, Kotb MM, et al. Intercostal nerve transfer in infants with obstetric brachial plexus palsy. Microsurgery 2008; 28:499.
Al-Qattan MM, Thallaj A, Abdelhamid MM. Ulnar nerve to musculocutaneous nerve transfer in an ulnar ray-deficient infant with brachial plexus birth palsy: case report. J Hand Surg Am 2010; 35:1432.
Noaman HH, Shiha AE, Bahm J. Oberlin’s ulnar nerve transfer to the biceps motor nerve in obstetric brachial plexus palsy: indications, and good and bad results. Microsurgery 2004; 24:182.





