Síndrome de Dificultad Respiratoria del Recién Nacido: Revisión.
El síndrome de dificultad respiratoria del recién nacido, anteriormente conocido como enfermedad de la membrana hialina, es un problema común en los bebés prematuros. Este trastorno es causado principalmente por la deficiencia de surfactante pulmonar en un pulmón inmaduro. Revisaremos las claves del diagnóstico y tratamiento de manera breve y puntual. La displasia broncopulmonar es una complicación frecuente que abordaremos al final de esta revisión.
El revestimiento del alvéolo consiste en un 90% de neumocitos tipo I y un 10% de tipo II. Después de las 20 semanas de gestación, las tipo II contienen cuerpos de inclusión laminares, osmófilos y vacuolados de material tensioactivo. Este surfactante lipoproteínico se compone en un 90% de lípidos y está compuesto predominantemente de fosfatidilcolina saturada (lecitina), pero también contiene fosfatidilglicerol, otros fosfolípidos y lípidos neutros. Las proteínas surfactantes, SP-A, SP-B, SP-C y SP-D, se empaquetan en el cuerpo laminar y contribuyen a las propiedades de superficie activa y al reciclaje del surfactante.
El surfactante previene la atelectasia al reducir la tensión superficial a bajos volúmenes pulmonares cuando se concentra al final de la espiración a medida que disminuye el radio alveolar. El surfactante contribuye a la retracción pulmonar al aumentar la tensión superficial en volúmenes pulmonares más grandes cuando se diluye durante la inspiración a medida que aumenta el radio alveolar. Sin el surfactante, las fuerzas de tensión superficial no se reducen, y se genera atelectasia durante la espiración final al colapsar el alvéolo. La etapa de producción del surfactante, en cantidades suficientes para prevenir la atelectasia, depende del aumento en los niveles de cortisol fetal que comienza entre las 32 y 34 semanas de gestación.
A las 34-36 semanas, los neumocitos tipo II en el pulmón producen suficiente surfactante y se secreta en el lumen alveolar y se excreta en el líquido amniótico. La concentración de lecitina en el líquido amniótico indica la madurez pulmonar fetal. Debido a que la cantidad de lecitina es difícil de cuantificar, se determina la proporción de lecitina (que aumenta con la madurez) y esfingomielina (que permanece constante durante la gestación; la relación L/S). Una relación L/S de 2:1 generalmente indica madurez pulmonar.
La presencia de cantidades menores de fosfolípidos, como el fosfatidilglicerol, también es indicativo de madurez pulmonar fetal y puede ser útil en situaciones en las que la relación L/S no es concluyente o esté posiblemente afectada por diabetes materna, lo que reduce la madurez pulmonar. La ausencia de fosfatidilglicerol sugiere que la producción de surfactante podría no haber alcanzado su madurez.
Factores de Riesgo del Síndrome de Dificultad Respiratoria del Recién Nacido
Los bebés con mayor riesgo de padecer síndrome de dificultad respiratoria del recién nacido son los prematuros con una relación L/S alterada. La incidencia del síndrome de dificultad respiratoria del recién nacido aumenta a menor edad gestacional. Se presenta en el 30-60% de los bebés entre las 28 y 32 semanas de gestación. Otros factores de riesgo incluyen el nacimiento de un bebé prematuro previo con síndrome de dificultad respiratoria, diabetes materna, hipotermia, sufrimiento fetal, asfixia, sexo masculino, raza blanca, siendo el segundo hijo de gemelos y nacimiento por cesárea.
El síndrome de dificultad respiratoria del recién nacido puede desarrollarse inmediatamente en la sala de partos en bebés extremadamente prematuros a las 26-30 semanas de gestación. Es posible que algunos bebés más maduros (34 semanas de gestación) no muestren signos de dificultad respiratoria hasta 3-4 horas después del nacimiento, lo que se relaciona con la liberación inicial de surfactante almacenado al inicio de la respiración, aunado a la incapacidad para reemplazarlo debido a las reservas insuficientes.
Fisiopatología del Síndrome de Dificultad Respiratoria del Recién Nacido
La deficiencia de surfactante pulmonar (secundaria a prematuridad) ocasiona atelectasia, disminución de la capacidad residual funcional, hipoxemia arterial y dificultad respiratoria. La síntesis de surfactante también puede verse reducida como resultado de hipovolemia, hipotermia, acidosis, hipoxemia y trastornos genéticos raros de la síntesis de surfactante. Estos factores también producen vasoespasmo en la arteria pulmonar, lo que puede contribuir al síndrome de dificultad respiratoria en bebés prematuros más grandes que han desarrollado suficiente músculo liso de la arteriola pulmonar para producir vasoconstricción.
La atelectasia inducida por deficiencia de surfactante hace que los alvéolos estén perfundidos pero no ventilados, lo que resulta en un corto circuito pulmonar e hipoxemia. A medida que aumenta la atelectasia, los pulmones se vuelven cada vez más difíciles de expandir, y la distensibilidad pulmonar disminuye. Debido a que la pared torácica del prematuro es muy distensible, el recién nacido intenta contrarrestar la disminución de la distensibilidad pulmonar mediante el aumento de la presión inspiratoria, lo que resulta en la retracción intercostal.
La disminución en la distensibilidad pulmonar y las retracciones de la pared torácica conducen a un intercambio de aire deficiente, con aumento del espacio muerto fisiológico, hipoventilación alveolar e hipercapnia. La hipoxia, hipercapnia y acidosis actúan sobre los neumocitos tipo II reduciendo la síntesis de surfactante y, en algunos casos, sobre las arteriolas pulmonares produciendo hipertensión pulmonar.
Presentación Clínica del Síndrome de Dificultad Respiratoria del Recién Nacido
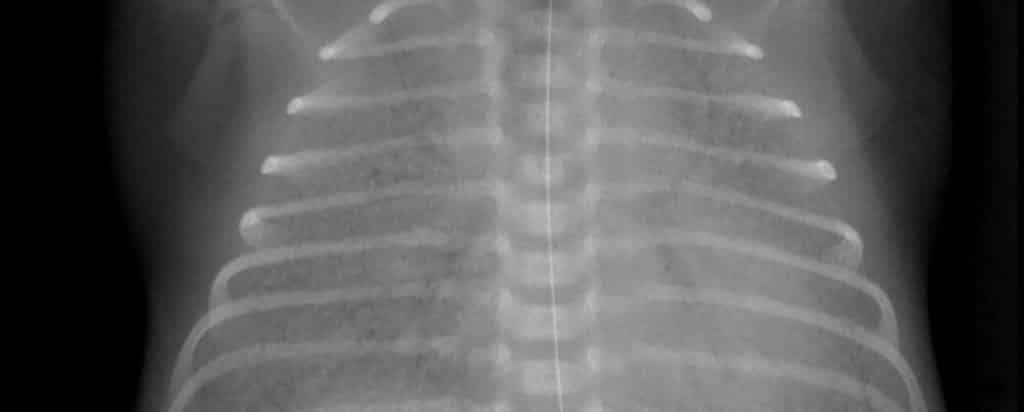
Las manifestaciones del síndrome de dificultad respiratoria incluyen cianosis, taquipnea, aleteo nasal, retracción intercostal y esternal, y quejido espiratorio. Éste último es causado por el cierre de la glotis durante la espiración, cuyo efecto es mantener el volumen pulmonar (disminución de la atelectasia) y el intercambio de gases durante la exhalación. Se puede observar atelectasia en la radiografía del tórax, describiendo un patrón retículo-granular en “vidrio esmerilado” que rodea los bronquios llenos de aire (broncograma aéreo).
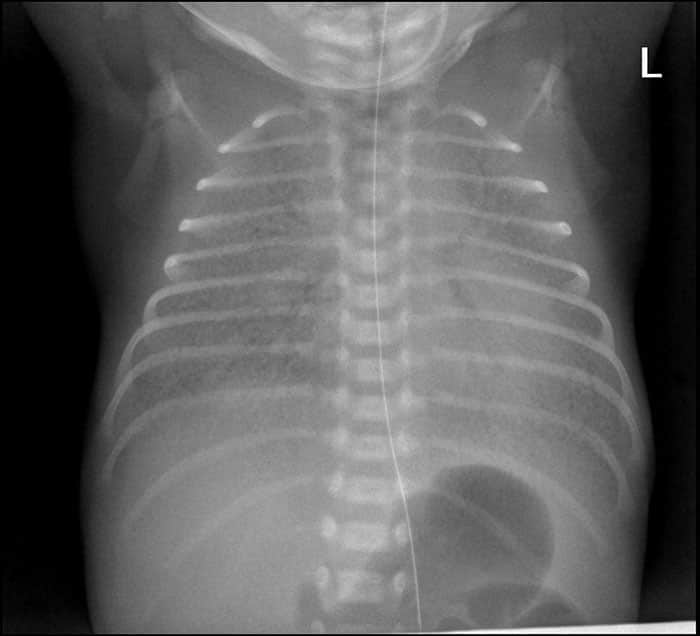
El síndrome de dificultad respiratoria grave puede presentarse como un campo pulmonar colapsado en la radiografía, incluso dificultando la distinción entre los pulmones atelectásicos y el corazón. Durante las primeras 72 horas, los bebés con síndrome de dificultad respiratoria del recién nacido no tratados tienen un aumento importante de la hipoxemia. En los bebés con síndrome de dificultad respiratoria grave, el desarrollo de edema, apnea e insuficiencia respiratoria requiere ventilación asistida.
Los casos no complicados tienen una mejoría espontánea que a menudo se manifiesta por diuresis y una marcada resolución del edema. Las complicaciones incluyen el desarrollo de un neumotórax, conducto arterioso permeable y displasia broncopulmonar.
Prevención y Tratamiento del Síndrome de Dificultad Respiratoria del Recién Nacido
Las estrategias para prevenir el parto prematuro incluyen el cerclaje cervical, el reposo en cama, el tratamiento de infecciones y la administración de medicamentos tocolíticos. Además, la prevención de hipotermia en el neonato, de la asfixia al nacer y la hipovolemia reducen el riesgo de síndrome de dificultad respiratoria del recién nacido. Si el parto prematuro es inevitable, la administración de corticosteroides (betametasona) a la madre (y por tanto al feto) estimula la producción de surfactante en el pulmón fetal; este enfoque requiere dosis múltiples durante al menos 48 horas.
Después del nacimiento, se puede prevenir el síndrome de dificultad respiratoria o reducir su gravedad mediante la administración intratraqueal de surfactante exógeno inmediatamente después del nacimiento en la sala de parto o dentro de unas pocas horas después del nacimiento. El surfactante exógeno se puede administrar repetidamente durante el curso del síndrome de dificultad respiratoria del recién nacido en pacientes que requieren intubación endotraqueal, ventilación mecánica y oxigenoterapia. La aplicación temprana de CPAP nasal también puede reducir la gravedad del padecimiento.
Parámetros a corregir
El nivel de PaO2 debe mantenerse entre 60 y 70 mmHg (saturación de oxígeno del 90%), y el pH por arriba de 7.25. Algunos bebés prematuros más grandes requieren únicamente de un aumento de la concentración de oxígeno inspirado cálido y humidificado administrado por una cánula nasal o una capucha de oxígeno. Si hay hipoxemia (PaO2 <50 mmHg) y la concentración necesaria de oxígeno inspirado es del 70-100%, se debe agregar CPAP nasal a una presión de distensión de 8-10 cmH2O. Si se produce una insuficiencia respiratoria (PCO2> 60 mm Hg, pH <7.20 y PaO2 <50 mmHg con 100% de oxígeno), se indica la ventilación asistida mediante un ventilador.
Los ventiladores de frecuencia convencional (25-60 respiraciones/min), chorro de alta frecuencia (150-600 respiraciones/min) y oscilatorios (900-3,000 respiraciones/min) han tenido éxito en el manejo de la insuficiencia respiratoria causada por un síndrome de dificultad respiratoria grave. Las configuraciones de inicio sugeridas en un ventilador convencional son fracción de oxígeno inspirado, 0.60-1.0; Presión inspiratoria máxima, 20-25 cmH2O; presión positiva al final de la espiración, 5 cmH2O; y frecuencia respiratoria, 30-50 respiraciones/min. En respuesta a la hipercapnia persistente, se debe aumentar la ventilación alveolar (volumen tidal – espacio muerto×frecuencia).
La ventilación puede aumentarse mediante un incremento en la frecuencia del ventilador o un aumento en el volumen corriente (el gradiente entre la presión inspiratoria máxima y la presión espiratoria final positiva usando un ventilador controlado por presión). En respuesta a la hipoxia, el contenido de oxígeno inspirado puede aumentarse. Alternativamente, el grado de oxigenación depende de la presión media de la vía aérea. La presión media de las vías respiratorias está directamente relacionada con la presión, el flujo y el tiempo inspiratorio positivos de la inhalación.
El aumento de la presión media de las vías respiratorias puede mejorar la oxigenación al mejorar el volumen pulmonar, mejorando la ventilación con la perfusión. Debido a la dificultad para distinguir la sepsis y la neumonía del síndrome de dificultad respiratoria del recién nacido, se administran antibióticos parenterales de amplio espectro (ampicilina y gentamicina) durante 48 a 72 horas, en espera del aislamiento de un organismo en el hemocultivo.
Displasia Broncopulmonar
La displasia broncopulmonar es un diagnóstico clínico definido por la dependencia de oxígeno a las 36 semanas de edad y acompañada de hallazgos clínicos y radiográficos característicos que corresponden a anomalías anatómicas. Las concentraciones de oxígeno superiores al 40% son tóxicas para el pulmón neonatal. La lesión pulmonar mediada por oxígeno resulta de la generación de superoxidos, peróxido de hidrógeno y radicales libres de oxígeno, que interrumpen los lípidos de la membrana. La ventilación asistida con altas presiones pico produce barotrauma, lo que agrava los efectos dañinos de los altos niveles de oxígeno inspirados.
En la mayoría de los pacientes, la displasia broncopulmonar se desarrolla después de la ventilación asistida para el manejo del síndrome de dificultad respiratoria del recién nacido. La inflamación ocasionada por la ventilación asistida prolongada y las infecciones sistémicas y pulmonares repetidas pueden desempeñar un papel importante. La ausencia de mejoría del síndrome de dificultad respiratoria después de 2 semanas, la necesidad de ventilación mecánica prolongada y la oxigenoterapia requerida a las 36 semanas de edad son características de los pacientes con síndrome de dificultad respiratoria en los que se desarrolla displasia broncopulmonar.
Esta anomalía también puede desarrollarse en bebés que pesan menos de 1,000 g y que requieren ventilación mecánica debido a una función respiratoria deficiente en ausencia de síndrome de dificultad respiratoria. El 50% de los bebés entre las 24 y 26 semanas de edad gestacional requieren oxígeno a las 36 semanas de edad corregida.
Hallazgos Radiográficos
Los hallazgos radiográficos de la displasia broncopulmonar se caracterizan inicialmente por opacificación pulmonar y, posteriormente, por el desarrollo de quistes acompañados de áreas de sobredistensión y atelectasia, que le dan al pulmón una apariencia esponjosa. La histopatología de la displasia broncopulmonar revela edema intersticial, atelectasia, metaplasia de la mucosa, fibrosis intersticial, bronquiolitis obliterante necrotizante y alvéolos sobredistendidos.
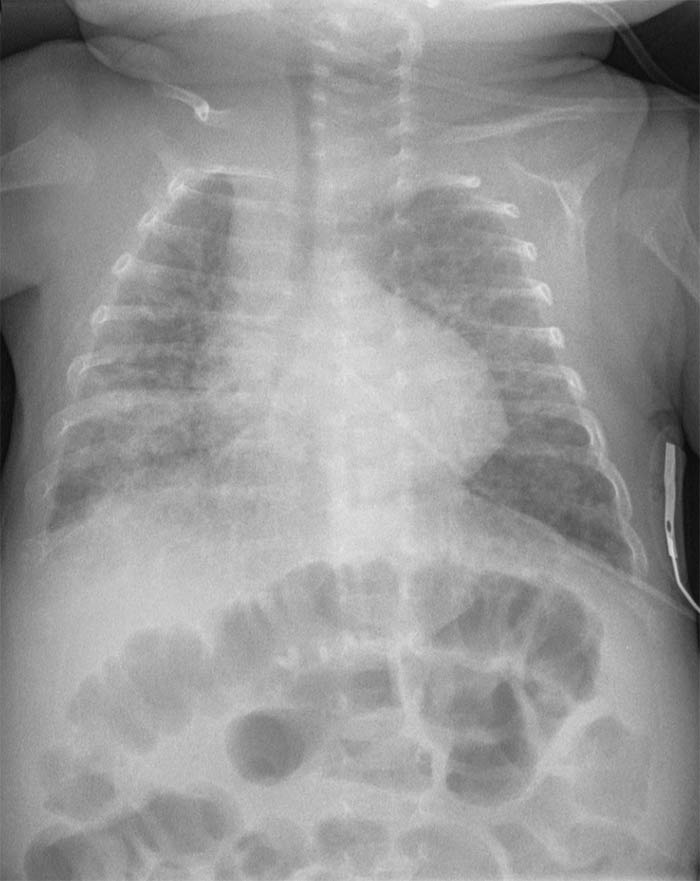
Clínica de la Displasia Broncopulmonar
Las manifestaciones clínicas de la displasia broncopulmonar son la dependencia de oxígeno, la hipercapnia con una alcalosis metabólica compensatoria, la hipertensión pulmonar, el crecimiento deficiente y el desarrollo de insuficiencia cardíaca derecha. También se observa una mayor resistencia de las vías respiratorias con broncoconstricción reactiva. La retracción costal grave producen una presión intersticial negativa que atrae líquido hacia el espacio intersticial. Junto con el cor pulmonale, estas retracciones del tórax causan retención de líquidos, lo que requiere la restricción de líquidos y la administración de diuréticos.
Tratamiento
Los pacientes con displasia broncopulmonar grave pueden necesitar tratamiento con ventilación mecánica durante muchos meses. Para reducir el riesgo de estenosis subglótica, se puede indicar una traqueotomía. Para reducir la toxicidad del oxígeno y el barotrauma, los ajustes del ventilador se reducen para mantener los gases sanguíneos con una PaO2 ligeramente más baja (50 mmHg) y niveles más altos de PaCO2 (50-75 mmHg) que en los lactantes durante la fase aguda del síndrome de dificultad respiratoria del recién nacido. La terapia con dexametasona puede reducir la inflamación, mejorar la función pulmonar y mejorar el destete de los pacientes con ventilación asistida.
Sin embargo, la dexametasona puede aumentar el riesgo de parálisis cerebral o resultados anormales del desarrollo neuromotor. Los sobrevivientes de la displasia broncopulmonar tienen hiperinflación, vías respiratorias reactivas y retraso en el desarrollo. Además, tienen un mayor riesgo de contraer neumonía grave por virus sincicial respiratorio y deben recibir profilaxis contra dicho patógeno.
Referencias Bibliográficas
Jobe AH. Lung Development and maturation. In: Neonatal-Perinatal Medicine, 9th ed, Martin RJ, Fanaroff AA, Walsh MC (Eds), Elsevier Mosby, St Louis 2010. Vol 2, p.1075.
Schmitz G, Müller G. Structure and function of lamellar bodies, lipid-protein complexes involved in storage and secretion of cellular lipids. J Lipid Res 1991; 32:1539.
Frank L, Sosenko IR. Development of lung antioxidant enzyme system in late gestation: possible implications for the prematurely born infant. J Pediatr 1987; 110:9.
Nogee LM, Garnier G, Dietz HC, et al. A mutation in the surfactant protein B gene responsible for fatal neonatal respiratory disease in multiple kindreds. J Clin Invest 1994; 93:1860.
Nogee LM, Dunbar AE 3rd, Wert SE, et al. A mutation in the surfactant protein C gene associated with familial interstitial lung disease. N Engl J Med 2001; 344:573.
Shulenin S, Nogee LM, Annilo T, et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency. N Engl J Med 2004; 350:1296.
Somaschini M, Nogee LM, Sassi I, et al. Unexplained neonatal respiratory distress due to congenital surfactant deficiency. J Pediatr 2007; 150:649.
Wert SE, Whitsett JA, Nogee LM. Genetic disorders of surfactant dysfunction. Pediatr Dev Pathol 2009; 12:253.
Jobe AH, Ikegami M. Biology of surfactant. Clin Perinatol 2001; 28:655.
Whitsett JA, Weaver TE. Hydrophobic surfactant proteins in lung function and disease. N Engl J Med 2002; 347:2141.
Whitsett JA, Wert SE, Weaver TE. Alveolar surfactant homeostasis and the pathogenesis of pulmonary disease. Annu Rev Med 2010; 61:105.
Nkadi PO, Merritt TA, Pillers DA. An overview of pulmonary surfactant in the neonate: genetics, metabolism, and the role of surfactant in health and disease. Mol Genet Metab 2009; 97:95.
Wu H, Kuzmenko A, Wan S, et al. Surfactant proteins A and D inhibit the growth of Gram-negative bacteria by increasing membrane permeability. J Clin Invest 2003; 111:1589.
Sato A, Whitsett JA, Scheule RK, Ikegami M. Surfactant protein-d inhibits lung inflammation caused by ventilation in premature newborn lambs. Am J Respir Crit Care Med 2010; 181:1098.
Verlato G, Cogo PE, Balzani M, et al. Surfactant status in preterm neonates recovering from respiratory distress syndrome. Pediatrics 2008; 122:102.
Hallman M, Kulovich M, Kirkpatrick E, et al. Phosphatidylinositol and phosphatidylglycerol in amniotic fluid: indices of lung maturity. Am J Obstet Gynecol 1976; 125:613.
Carlton DP, Albertine KH, Cho SC, et al. Role of neutrophils in lung vascular injury and edema after premature birth in lambs. J Appl Physiol (1985) 1997; 83:1307.
Clark RH, Gerstmann DR, Jobe AH, et al. Lung injury in neonates: causes, strategies for prevention, and long-term consequences. J Pediatr 2001; 139:478.
Naik AS, Kallapur SG, Bachurski CJ, et al. Effects of ventilation with different positive end-expiratory pressures on cytokine expression in the preterm lamb lung. Am J Respir Crit Care Med 2001; 164:494.
Brus F, van Oeveren W, Okken A, Oetomo SB. Number and activation of circulating polymorphonuclear leukocytes and platelets are associated with neonatal respiratory distress syndrome severity. Pediatrics 1997; 99:672.
Turunen R, Nupponen I, Siitonen S, et al. Onset of mechanical ventilation is associated with rapid activation of circulating phagocytes in preterm infants. Pediatrics 2006; 117:448.
Buss IH, Senthilmohan R, Darlow BA, et al. 3-Chlorotyrosine as a marker of protein damage by myeloperoxidase in tracheal aspirates from preterm infants: association with adverse respiratory outcome. Pediatr Res 2003; 53:455.
Cheah FC, Winterbourn CC, Darlow BA, et al. Nuclear factor kappaB activation in pulmonary leukocytes from infants with hyaline membrane disease: associations with chorioamnionitis and Ureaplasma urealyticum colonization. Pediatr Res 2005; 57:616.
Nitta K, Kobayashi T. Impairment of surfactant activity and ventilation by proteins in lung edema fluid. Respir Physiol 1994; 95:43.
Smith DE, Otulakowski G, Yeger H, et al. Epithelial Na(+) channel (ENaC) expression in the developing normal and abnormal human perinatal lung. Am J Respir Crit Care Med 2000; 161:1322.
Helve O, Pitkänen OM, Andersson S, et al. Low expression of human epithelial sodium channel in airway epithelium of preterm infants with respiratory distress. Pediatrics 2004; 113:1267.
Jobe AH, Hillman N, Polglase G, et al. Injury and inflammation from resuscitation of the preterm infant. Neonatology 2008; 94:190.
Edberg KE, Sandberg K, Silberberg A, et al. Lung volume, gas mixing, and mechanics of breathing in mechanically ventilated very low birth weight infants with idiopathic respiratory distress syndrome. Pediatr Res 1991; 30:496.
Macklem PT, Proctor DF, Hogg JC. The stability of peripheral airways. Respir Physiol 1970; 8:191.
NELSON NM, PROD’HOM LS, CHERRY RB, et al. Pulmonary function in the newborn infant. II. Perfusion–estimation by analysis of the arterial-alveolar carbon dioxide difference. Pediatrics 1962; 30:975.
Goldsmith J, Karotkin E. Assisted Ventilation of the Neonate, 4th ed, WB Saunders, Philadelphia 2003.
Stoll BJ, Hansen NI, Bell EF, et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics 2010; 126:443.
Consortium on Safe Labor, Hibbard JU, Wilkins I, et al. Respiratory morbidity in late preterm births. JAMA 2010; 304:419.
Anadkat JS, Kuzniewicz MW, Chaudhari BP, et al. Increased risk for respiratory distress among white, male, late preterm and term infants. J Perinatol 2012; 32:780.
Committee on Fetus and Newborn, American Academy of Pediatrics. Respiratory support in preterm infants at birth. Pediatrics 2014; 133:171.
Sakonidou S, Dhaliwal J. The management of neonatal respiratory distress syndrome in preterm infants (European Consensus Guidelines–2013 update). Arch Dis Child Educ Pract Ed 2015; 100:257.
Polin RA, Carlo WA, Committee on Fetus and Newborn, American Academy of Pediatrics. Surfactant replacement therapy for preterm and term neonates with respiratory distress. Pediatrics 2014; 133:156.
Verder H, Albertsen P, Ebbesen F, et al. Nasal continuous positive airway pressure and early surfactant therapy for respiratory distress syndrome in newborns of less than 30 weeks’ gestation. Pediatrics 1999; 103:E24.
Van Marter LJ, Allred EN, Pagano M, et al. Do clinical markers of barotrauma and oxygen toxicity explain interhospital variation in rates of chronic lung disease? The Neonatology Committee for the Developmental Network. Pediatrics 2000; 105:1194.
Aly H, Milner JD, Patel K, El-Mohandes AA. Does the experience with the use of nasal continuous positive airway pressure improve over time in extremely low birth weight infants? Pediatrics 2004; 114:697.
Ho JJ, Subramaniam P, Davis PG. Continuous distending pressure for respiratory distress in preterm infants. Cochrane Database Syst Rev 2015; :CD002271.
Wyckoff MH, Aziz K, Escobedo MB, et al. Part 13: Neonatal Resuscitation: 2015 American Heart Association Guidelines Update for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation 2015; 132:S543.
Perlman JM, Wyllie J, Kattwinkel J, et al. Part 7: Neonatal Resuscitation: 2015 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations. Circulation 2015; 132:S204.
Fischer HS, Bührer C. Avoiding endotracheal ventilation to prevent bronchopulmonary dysplasia: a meta-analysis. Pediatrics 2013; 132:e1351.
Schmölzer GM, Kumar M, Pichler G, et al. Non-invasive versus invasive respiratory support in preterm infants at birth: systematic review and meta-analysis. BMJ 2013; 347:f5980.
Subramaniam P, Ho JJ, Davis PG. Prophylactic nasal continuous positive airway pressure for preventing morbidity and mortality in very preterm infants. Cochrane Database Syst Rev 2016; :CD001243.
SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network, Finer NN, Carlo WA, et al. Early CPAP versus surfactant in extremely preterm infants. N Engl J Med 2010; 362:1970.
Vaucher YE, Peralta-Carcelen M, Finer NN, et al. Neurodevelopmental outcomes in the early CPAP and pulse oximetry trial. N Engl J Med 2012; 367:2495.
Stevens TP, Finer NN, Carlo WA, et al. Respiratory outcomes of the surfactant positive pressure and oximetry randomized trial (SUPPORT). J Pediatr 2014; 165:240.
Davis PG, Henderson-Smart DJ. Nasal continuous positive airways pressure immediately after extubation for preventing morbidity in preterm infants. Cochrane Database Syst Rev 2003; :CD000143.
Schmidt B, Roberts RS, Davis P, et al. Caffeine therapy for apnea of prematurity. N Engl J Med 2006; 354:2112.
Patel RM, Zimmerman K, Carlton DP, et al. Early Caffeine Prophylaxis and Risk of Failure of Initial Continuous Positive Airway Pressure in Very Low Birth Weight Infants. J Pediatr 2017; 190:108.
Dargaville PA, Gerber A, Johansson S, et al. Incidence and Outcome of CPAP Failure in Preterm Infants. Pediatrics 2016; 138.
Doyle LW, Carse E, Adams AM, et al. Ventilation in Extremely Preterm Infants and Respiratory Function at 8 Years. N Engl J Med 2017; 377:329.
Dylag AM, Mayer CA, Raffay TM, et al. Long-term effects of recurrent intermittent hypoxia and hyperoxia on respiratory system mechanics in neonatal mice. Pediatr Res 2017; 81:565.
Lemyre B, Laughon M, Bose C, Davis PG. Early nasal intermittent positive pressure ventilation (NIPPV) versus early nasal continuous positive airway pressure (NCPAP) for preterm infants. Cochrane Database Syst Rev 2016; 12:CD005384.
Roberts CT, Owen LS, Manley BJ, et al. Nasal High-Flow Therapy for Primary Respiratory Support in Preterm Infants. N Engl J Med 2016; 375:1142.
Ambalavanan N, Carlo WA, Wrage LA, et al. PaCO2 in surfactant, positive pressure, and oxygenation randomised trial (SUPPORT). Arch Dis Child Fetal Neonatal Ed 2015; 100:F145.
Thome UH, Genzel-Boroviczeny O, Bohnhorst B, et al. Permissive hypercapnia in extremely low birthweight infants (PHELBI): a randomised controlled multicentre trial. Lancet Respir Med 2015; 3:534.
Thome UH, Genzel-Boroviczeny O, Bohnhorst B, et al. Neurodevelopmental outcomes of extremely low birthweight infants randomised to different PCO2 targets: the PHELBI follow-up study. Arch Dis Child Fetal Neonatal Ed 2017; 102:F376.
Suresh GK, Soll RF. Overview of surfactant replacement trials. J Perinatol 2005; 25 Suppl 2:S40.
Fujiwara T, Maeta H, Chida S, et al. Artificial surfactant therapy in hyaline-membrane disease. Lancet 1980; 1:55.
Liechty EA, Donovan E, Purohit D, et al. Reduction of neonatal mortality after multiple doses of bovine surfactant in low birth weight neonates with respiratory distress syndrome. Pediatrics 1991; 88:19.
Kendig JW, Notter RH, Cox C, et al. Surfactant replacement therapy at birth: final analysis of a clinical trial and comparisons with similar trials. Pediatrics 1988; 82:756.
Hintz SR, Poole WK, Wright LL, et al. Changes in mortality and morbidities among infants born at less than 25 weeks during the post-surfactant era. Arch Dis Child Fetal Neonatal Ed 2005; 90:F128.
Hoekstra RE, Jackson JC, Myers TF, et al. Improved neonatal survival following multiple doses of bovine surfactant in very premature neonates at risk for respiratory distress syndrome. Pediatrics 1991; 88:10.
Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants – 2010 update. Neonatology 2010; 97:402.
Ardell S, Pfister RH, Soll R. Animal derived surfactant extract versus protein free synthetic surfactant for the prevention and treatment of respiratory distress syndrome. Cochrane Database Syst Rev 2015; :CD000144.
Singh N, Halliday HL, Stevens TP, et al. Comparison of animal-derived surfactants for the prevention and treatment of respiratory distress syndrome in preterm infants. Cochrane Database Syst Rev 2015; :CD010249.
Trembath A, Hornik CP, Clark R, et al. Comparative effectiveness of surfactant preparations in premature infants. J Pediatr 2013; 163:955.
US Food and Drug Administration. Approval of Lucinactant for neonatal respiratory distress syndrome. http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm294984.htm (Accessed on March 26, 2012).
Sinha SK, Lacaze-Masmonteil T, Valls i Soler A, et al. A multicenter, randomized, controlled trial of lucinactant versus poractant alfa among very premature infants at high risk for respiratory distress syndrome. Pediatrics 2005; 115:1030.
Corbet A, Gerdes J, Long W, et al. Double-blind, randomized trial of one versus three prophylactic doses of synthetic surfactant in 826 neonates weighing 700 to 1100 grams: effects on mortality rate. American Exosurf Neonatal Study Groups I and IIa. J Pediatr 1995; 126:969.
Yost CC, Soll RF. Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome. Cochrane Database Syst Rev 2000; :CD001456.
Bahadue FL, Soll R. Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome. Cochrane Database Syst Rev 2012; 11:CD001456.
Tarawneh A, Kaczmarek J, Bottino MN, Sant’anna GM. Severe airway obstruction during surfactant administration using a standardized protocol: a prospective, observational study. J Perinatol 2012; 32:270.
Dargaville PA, Aiyappan A, Cornelius A, et al. Preliminary evaluation of a new technique of minimally invasive surfactant therapy. Arch Dis Child Fetal Neonatal Ed 2011; 96:F243.
Abdel-Latif ME, Osborn DA. Laryngeal mask airway surfactant administration for prevention of morbidity and mortality in preterm infants with or at risk of respiratory distress syndrome. Cochrane Database Syst Rev 2011; :CD008309.
Göpel W, Kribs A, Ziegler A, et al. Avoidance of mechanical ventilation by surfactant treatment of spontaneously breathing preterm infants (AMV): an open-label, randomised, controlled trial. Lancet 2011; 378:1627.
Kanmaz HG, Erdeve O, Canpolat FE, et al. Surfactant administration via thin catheter during spontaneous breathing: randomized controlled trial. Pediatrics 2013; 131:e502.
More K, Sakhuja P, Shah PS. Minimally invasive surfactant administration in preterm infants: a meta-narrative review. JAMA Pediatr 2014; 168:901.
Pinheiro JM, Santana-Rivas Q, Pezzano C. Randomized trial of laryngeal mask airway versus endotracheal intubation for surfactant delivery. J Perinatol 2016; 36:196.
Roberts KD, Brown R, Lampland AL, et al. Laryngeal Mask Airway for Surfactant Administration in Neonates: A Randomized, Controlled Trial. J Pediatr 2018; 193:40.
Minocchieri S, Berry CA, Pillow JJ, CureNeb Study Team. Nebulised surfactant to reduce severity of respiratory distress: a blinded, parallel, randomised controlled trial. Arch Dis Child Fetal Neonatal Ed 2018.
Klotz D, Porcaro U, Fleck T, Fuchs H. European perspective on less invasive surfactant administration-a survey. Eur J Pediatr 2017; 176:147.
Aldana-Aguirre JC, Pinto M, Featherstone RM, Kumar M. Less invasive surfactant administration versus intubation for surfactant delivery in preterm infants with respiratory distress syndrome: a systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed 2017; 102:F17.
Rigo V, Lefebvre C, Broux I. Surfactant instillation in spontaneously breathing preterm infants: a systematic review and meta-analysis. Eur J Pediatr 2016; 175:1933.
Isayama T, Iwami H, McDonald S, Beyene J. Association of Noninvasive Ventilation Strategies With Mortality and Bronchopulmonary Dysplasia Among Preterm Infants: A Systematic Review and Meta-analysis. JAMA 2016; 316:611.
Cools F. A new method of surfactant administration in preterm infants. Lancet 2011; 378:1607.
Venkataraman R, Kamaluddeen M, Hasan SU, et al. Intratracheal Administration of Budesonide-Surfactant in Prevention of Bronchopulmonary Dysplasia in Very Low Birth Weight Infants: A Systematic Review and Meta-Analysis. Pediatr Pulmonol 2017; 52:968.
Kumar P, Committee on Fetus and Newborn, American Academy of Pediatrics. Use of inhaled nitric oxide in preterm infants. Pediatrics 2014; 133:164.
Carey WA, Weaver AL, Mara KC, Clark RH. Inhaled Nitric Oxide in Extremely Premature Neonates With Respiratory Distress Syndrome. Pediatrics 2018.
Bell EF, Acarregui MJ. Restricted versus liberal water intake for preventing morbidity and mortality in preterm infants. Cochrane Database Syst Rev 2014; :CD000503.
Stewart A, Brion LP, Soll R. Diuretics for respiratory distress syndrome in preterm infants. Cochrane Database Syst Rev 2011; :CD001454.
Fuchs H, Lindner W, Leiprecht A, et al. Predictors of early nasal CPAP failure and effects of various intubation criteria on the rate of mechanical ventilation in preterm infants of <29 weeks gestational age. Arch Dis Child Fetal Neonatal Ed 2011; 96:F343.
Hatch LD, Grubb PH, Lea AS, et al. Endotracheal Intubation in Neonates: A Prospective Study of Adverse Safety Events in 162 Infants. J Pediatr 2016; 168:62.
Ratner I, Whitfield J. Acquired subglottic stenosis in the very-low-birth-weight infant. Am J Dis Child 1983; 137:40.





