Fimosis, parafimosis, criptorquidia y reflujo vesicoureteral en pediatría.
En esta breve revisión abordaremos primeramente la patología prepucial, dentro de la que destaca la fimosis y parafimosis, seguido de la criptorquidia y concluimos con la revisión del reflujo vesicoureteral.
En el 95% de los recién nacidos el prepucio cubre el glande y poco a poco se va haciendo más laxo hasta dejarlo descubierto a los cuatro años de edad. Las adherencias balano-prepuciales se localizan entre el epitelio prepucial y el glande, lo que no permite visualizar el glande por completo. El paciente no refiere dolor y no requiere tratamiento quirúrgico a menos que se presenten infecciones.
Fimosis
La fimosis, por otro lado, se refiere a la estrechez del prepucio que impide su descubrimiento. Se divide en formas fisiológicas y patológicas. La fimosis fisiológica, que se observa en casi todos los varones recién nacidos, se debe al desarrollo normal de las adherencias congénitas entre el prepucio y el glande. El examen físico revela un orificio prepucial flexible sin cicatrices.
La fimosis patológica se define como el prepucio que no es retráctil secundario a su cicatrización distal, como ocurre con la fibrosis prepucial debida a infección e inflamación. Esta cicatrización a menudo aparece como un anillo fibroso blanco contraído alrededor del orificio prepucial. La incidencia informada de fimosis patológica es de hasta un 16%. Los síntomas incluyen:
- Irritación o sangrado por el orificio prepucial.
- Disuria.
- Erección dolorosa.
- Balanopostitis recurrente.
- Retención urinaria crónica con globo que solo se resuelve con compresión manual.
La fimosis patológica aumenta el riesgo de otras complicaciones del prepucio, como la parafimosis, infecciones del tracto urinario recurrentes, balanopostitis recurrente y/o grave y balanitis xerotica obliterans. Ante un caso de fimosis patológica se debe interconsultar al urólogo pediatra.
Tratamiento de la Fimosis
Existen varias opciones para el tratamiento de la fimosis patológica, y nunca se debe aconsejar sobre la “necesidad” de una circuncisión sin antes considerar intervenciones más conservadoras. Los ejercicios de estiramiento del prepucio tienen cierto éxito en el tratamiento de la fimosis patológica. Estos consisten en retraer el prepucio hasta la visualización de la cicatriz durante un minuto, realizado cuatro veces diariamente durante uno a tres meses.
Los corticosteroides tópicos, que generalmente se administran junto con ejercicios de estiramiento, son eficaces en la mayoría de los niños con fimosis patológica. La crema de betametasona (0.05%) es el agente tópico más utilizado, aplicada dos veces al día directamente sobre y alrededor del anillo fimótico durante seis semanas.
En pacientes sin respuesta al tratamiento con corticosteroides tópicos, las opciones quirúrgicas se presentan al paciente y/o familia, y la elección de la intervención se basa en los hallazgos clínicos y la preferencia del paciente y/o familia. La circuncisión está indicada ante infecciones del tracto urinario de repetición, parafimosis recurrente y la fimosis puntiforme. En esta última, el orificio del prepucio es muy pequeño y obstaculiza la micción.
Parafimosis
La parafimosis se refiere a un prepucio retraído en un hombre no circuncidado que no puede ser devuelto a su posición normal. En bebés y niños pequeños, la parafimosis generalmente es el resultado de la retracción involuntaria o forzada del prepucio fisiológicamente fimótico por parte del cuidador durante la limpieza del pene. En el adolescente o adulto sexualmente activo, el coito es un precipitante común.
El diagnóstico de parafimosis se basa en los hallazgos clínicos. El edema y el dolor grave en el pene son los dos datos referidos más comunes en los hombres no circuncidados con parafimosis. A la exploración, el glande y el prepucio distal aparecen edematizados con constricción presente en el surco coronal. La decoloración azul o negruzca de la piel del glande y su firmeza durante la palpación indican isquemia.
Tratamiento de la Parafimosis
El tratamiento primario de la parafimosis consiste en la reducción oportuna del prepucio sobre el glande del pene y requiere:
- Control de dolor
- Reducción manual que puede ser facilitada por métodos para reducir el edema (frío) si el tiempo lo permite.
- Uso de técnicas más invasivas, generalmente por un urólogo, si la reducción manual no tiene éxito.
La reducción manual exitosa generalmente puede ser realizada por el médico de atención primaria o de urgencias, pudiendo hacer uso de la técnica de Dundee. Se requiere de la interconsulta con un urólogo o un cirujano con experiencia similar ante pacientes con parafimosis y:
- Necrosis del pene.
- Obstrucción urinaria completa.
- Reducción fallida mediante técnica manual.
Si la atención del subespecialista no está disponible de manera urgente, el médico debe proceder a reducir la parafimosis. Para pacientes sin signos de isquemia del pene u obstrucción urinaria, deberás comenzar con la reducción manual y avanzar a un procedimiento de corte dorsal solo si la reducción no es exitosa.
Cuidados y Seguimiento
Las claves del cuidado posterior después de la reducción de la parafimosis incluyen:
- Evitar la retracción del prepucio durante una semana.
- Reforzar una higiene adecuada y evitar la retracción forzada del prepucio en el niño pequeño.
- Para los pacientes con desgarros menores al prepucio después de la reducción, la aplicación de la pomada antibiótica triple al prepucio sin realizar retracción.
- Acudir a urgencias si aparecen signos de infección (p.e. enrojecimiento, inflamación, dolor o drenaje de pus)
- En adolescentes y adultos, evitar las relaciones sexuales durante varios días.
El seguimiento con un urólogo después de la reducción de la parafimosis está indicado para pacientes con lo siguiente:
- Traumatismo importante durante la reducción mínimamente invasiva.
- Parafimosis recurrente.
- Posterior a una reducción invasiva de la parafimosis.
Criptorquidia
Un testículo que no está dentro del escroto y no desciende espontáneamente al mismo a los cuatro meses de edad (o la edad corregida para los bebés prematuros) es un testículo criptorquídico. En la mayoría de los casos de criptorquidia los testículos no descienden, pero en algunos se debe a agenesia o atrofia. Los testículos no descendidos se detienen a lo largo de su trayectoria normal de descenso hacia el escroto.
Pueden permanecer en la cavidad abdominal o palparse en el canal inguinal (intracanalicular) o justo fuera del anillo externo. Entre el 2 y el 5% de los recién nacidos a término y aproximadamente el 30% de los bebés prematuros nacen con un testículo no descendido. La criptorquidia suele ser un hallazgo aislado. Sin embargo, puede ocurrir en asociación con trastornos endocrinos, síndromes genéticos y anomalías morfológicas.
Las características clínicas de la criptorquidia incluyen un escroto o hemiscroto vacío e hipoplásico o pobremente rugoso. Puede haber plenitud inguinal. La mayoría de los testículos no descendidos descienden espontáneamente a los seis meses de edad. Algunos testículos que han descendido completamente en la lactancia ascenderán a una posición “no descendida” durante la infancia (generalmente entre los cuatro y ocho años).
Evaluación del Paciente
La evaluación del paciente con criptorquidia suele incluir la historia clínica y exploración física. Los estudios de imagen y laboratorio no están indicados de forma rutinaria, pero pueden ser necesarios para excluir condiciones asociadas. El abordaje diagnóstico de la criptorquidia depende de si el testículo es palpable o no. El diagnóstico de criptorquidia se puede hacer si el testículo es palpable en el canal inguinal o justo fuera del anillo externo, y ha estado en esta posición desde su nacimiento.
A diferencia de los testículos retráctiles, los testículos no descendidos palpables no pueden ser ordeñados hacia una posición escrotal normal y/o no permanecerán en una posición escrotal normal si se realiza el reflejo cremastérico. Los testículos palpables no descendidos se diferencian de los ectópicos por su posición (intracanalicular o suprascrotal versus suprapúbico, canal femoral, perineo o compartimento escrotal contralateral).
Diagnóstico de Criptorquidia
Las principales consideraciones diagnósticas para un testículo unilateral no palpable incluyen criptorquidia, testículo ausente o ectópico. La exploración quirúrgica suele ser necesaria para distinguir entre estas posibilidades. En caso de testículos bilaterales no palpables, el posible diagnóstico incluye trastornos del desarrollo sexual, criptorquidia, anorquia y atrofia testicular bilateral. La evaluación diagnóstica difiere según la edad.
Los recién nacidos fenotípicamente varones con testículos bilaterales no palpables, testículos unilaterales no palpables con hipospadias o sospecha de trastorno del desarrollo sexual (incluida la hiperplasia suprarrenal congénita), deben remitirse de inmediato a un equipo multidisciplinario para evaluación y manejo de un posible trastorno del desarrollo sexual. Las indicaciones para la derivación a un urólogo pediatra pueden incluir:
- Testículos congénitos palpables o no palpables no descendidos (unilaterales o bilaterales); Se recomienda referir entre los 4 y 12 meses de edad.
- Testículos ascendentes en niños después de la infancia.
- Tejido palpable en el escroto como probable testículo atrófico.
- Dificultad para diferenciar entre testículos no descendidos, retráctiles o ectópicos (a cualquier edad).
Tratamiento de la Criptorquidia
La mayoría de los testículos que no descienden al nacer completan su descenso dentro de los primeros tres a cuatro meses de vida. El descenso espontáneo es raro después de los seis meses de edad. En los testículos que permanecen sin descender, los cambios relacionados con la fertilidad pueden comenzar antes del año de edad. Las complicaciones y secuelas de la criptorquidia incluye hernia inguinal, torsión testicular, traumatismo, infertilidad y cáncer testicular.
La gravedad de estas complicaciones y secuelas exige una derivación temprana para un tratamiento definitivo. El tratamiento hormonal mediante hCG ya no está recomendado. El objetivo del tratamiento quirúrgico es colocar y reparar los testículos no descendidos viables en una posición escrotal normal (orquidopexia) o eliminar los restos testiculares no viables (orquiectomía). La posición escrotal reduce el riesgo de torsión y lesiones traumáticas contusas (para los testículos intracanaliculares).
Si se realiza con suficiente anticipación, la corrección quirúrgica también puede reducir el riesgo de infertilidad y cáncer testicular. Se recomienda el tratamiento quirúrgico de la criptorquidia tan pronto como sea posible después de los cuatro meses de edad y definitivamente debe completarse antes de que el niño cumpla los dos años de edad. En niños con ascenso testicular durante la infancia, la cirugía generalmente se debe realizar dentro de los primeros seis meses del diagnóstico. Los testículos retráctiles deben evaluarse anualmente. En muchos casos esto requerirá seguimiento hasta la pubertad.
Reflujo Vesicoureteral
El reflujo vesicoureteral es el paso retrógrado de la orina desde la vejiga hacia el tracto urinario superior. Se divide en dos categorías según la etiopatogenia subyacente. El reflujo vesicoureteral primario, la forma más común (70%), se debe al cierre incompetente o inadecuado de la unión ureterovesical, que contiene un segmento del uréter dentro de la pared de la vejiga (uréter intravesical). Es bilateral en el 50% de los casos y en el 35-50% existe un factor de herencia familiar autosómico dominante con penetrancia incompleta.
El reflujo vesicoureteral primario ocurre en aproximadamente el 1% de los recién nacidos. Sin embargo, existe una tasa significativa de resolución espontánea con el crecimiento, especialmente en pacientes con reflujo de bajo grado. El reflujo vesicoureteral secundario es el resultado de una presión de vaciado anormalmente alta en la vejiga que produce un fallo en el cierre de la unión ureterovesical durante la contracción de la vejiga. Existen múltiples causas:
- Duplicación ureteral: el reflujo vesicoureteral suele aparecer en el uréter que drena el polo inferior del riñón.
- Divertículos ureterales.
- Uréter ectópico.
- Ureterocele.
- Vejiga neurógena.
- Riñón multiquístico displásico.
- Agenesia renal.
- Válvulas de uretra posterior: es la causa más frecuente de uropatía obstructiva grave en niños. Afecta sólo a varones. Evoluciona a enfermedad renal terminal en el 30% de los casos. Lleva asociado reflujo vesicoureteral en el 50% de los casos. El diagnóstico se realiza de la siguiente forma:
- Intraútero: mediante la detección por ecografía prenatal de hidronefrosis con oligoamnios.
- Neonatal: al detectar a un varón con una masa suprapúbica y con un chorro miccional débil o por goteo.
Evaluación del Reflujo Vesicoureteral
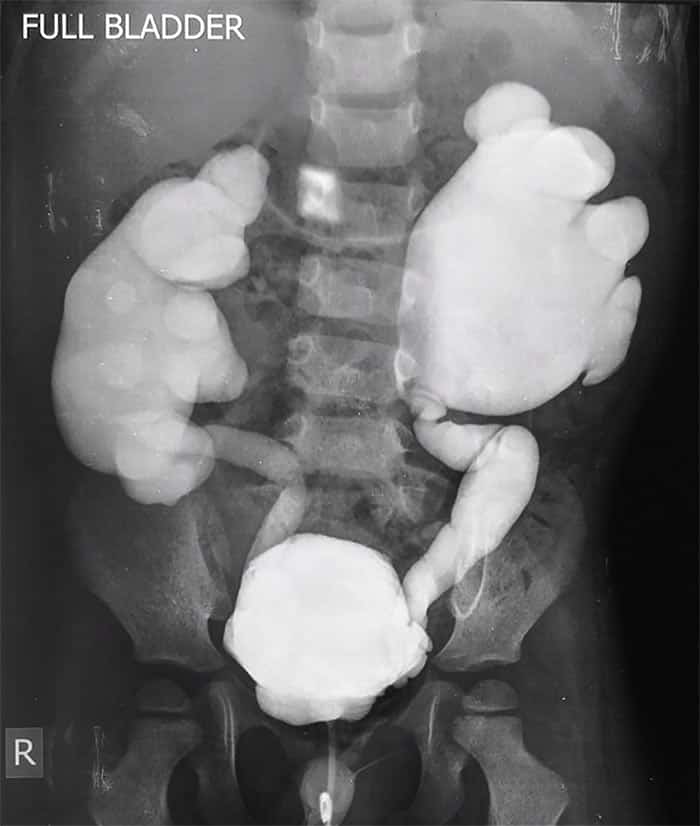
El reflujo vesicoureteral se presenta prenatalmente como hidronefrosis en la ecografía. Después del nacimiento, típicamente después de una infección del tracto urinario febril, o, con menor frecuencia, después de una evaluación familiar de un caso índice. El diagnóstico de reflujo vesicoureteral se basa en la demostración de reflujo de orina desde la vejiga hacia el tracto urinario superior mediante cistoureterografía miccional seriada (CUMS).
La CUMS es el estudio de imagen de elección para diagnosticar la presencia y establecer el grado de reflujo vesicoureteral. La gravedad depende del grado de llenado retrógrado y la dilatación del sistema colector renal. Se debe realizar una ecografía renal postnatal en todos los pacientes que presentan hidronefrosis prenatal. Mientras que en niños se realiza una CUMS ante hallazgos anormales persistentes en la ecografía postnatal o que desarrollan infecciones del tracto urinario recurrentes.
De lo contrario, se realiza una CUMS en niños después de una primera infección urinaria febril o sintomática si no están entrenados para usar el baño, tienen una anomalía sugerente en el ultrasonido renal, presentan hipertensión o un crecimiento deficiente, o una combinación de temperatura ≥39°C y un patógeno distinto de Escherichia coli en el urocultivo.
Clasificación
Existe una clasificación en cinco grados que tiene implicaciones pronósticas y terapéuticas (a mayor grado de reflujo, mayor probabilidad de lesión renal):
- Grado I: Reflujo hacia la parte distal de un uréter no dilatado.
- Grado II: Reflujo hasta la pelvis renal pero sin dilatación de los cálices.
- Grado III: Reflujo con dilatación moderada de los cálices y del uréter.
- Grado IV: Reflujo hacia un uréter intensamente dilatado así como más del 50% de los cálices.
- Grado V. Reflujo masivo con pérdida de morfología calicial normal, con uréter muy dilatado y tortuoso.
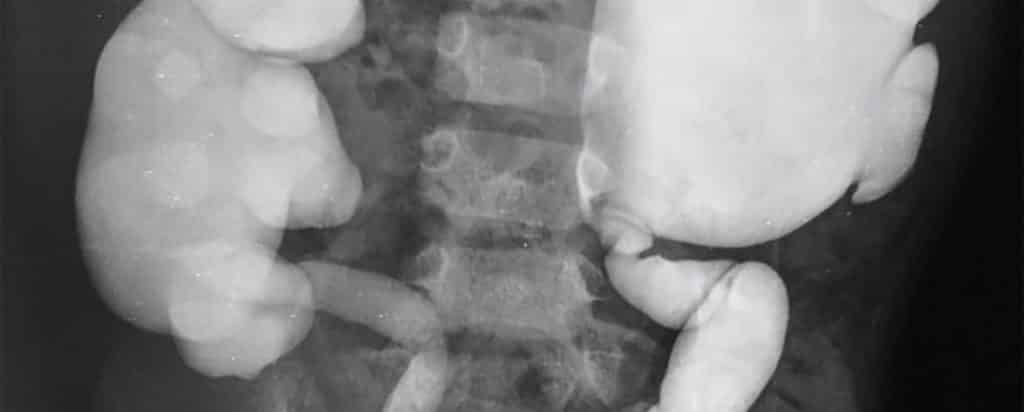
Evaluación Adicional
Los niños con reflujo vesicoureteral tienen riesgo de infecciones del tracto urinario recurrentes febriles o sintomáticas, especialmente aquellos con reflujo vesicoureteral más grave. La pérdida de parénquima renal es un hallazgo frecuente. Puede conducir a una disminución de la función renal, y en algunos casos con afectación bilateral grave a la enfermedad renal terminal. La reducción del parénquima renal es causada por los siguientes mecanismos:
- Cicatrización por infección renal parenquimatosa, que puede ocurrir en personas con cualquier grado de reflujo, pero es más común en personas con grados más altos (III a V).
- Hipoplasia renal congénita.
Se recomienda realizar la siguiente evaluación en todos los niños con reflujo vesicoureteral:
- Evaluación médica que incluye mediciones de altura, peso y presión arterial, e identificación de síntomas de disfunción miccional.
- Examen general de orina.
- Creatinina sérica si hay afectación bilateral o en un paciente con un riñón solitario.
- Ecografía renal y en pacientes seleccionados gammagrafía renal con ácido dimercaptosuccínico (DMSA).
- Cribado en hermanos menores o descendientes del caso índice.
Tratamiento del Reflujo Vesicoureteral
El objetivo del tratamiento es prevenir la pielonefritis, la lesión renal y sus complicaciones. La elección del tratamiento depende de si el reflujo vesicoureteral es primario o secundario, así como su gravedad. Se indica profilaxis antibiótica en niños con reflujo vesicoureteral leve si presentan infección del tracto urinario de repetición o datos de daño renal en la DMSA. También está recomendada en pacientes con reflujo vesicoureteral grado IV o V. Se indican dosis bajas de cotrimoxazol, amoxicilina, sola o combinada con ácido clavulánico.
La cirugía abierta o endoscópica se realiza en los casos de reflujo secundario y en los primarios en los que se espera que no desaparezcan y/o se lesione aún más al riñón por el grado o repercusiones morfológicas.
Referencias Bibliográficas
McGregor TB, Pike JG, Leonard MP. Pathologic and physiologic phimosis: approach to the phimotic foreskin. Can Fam Physician 2007; 53:445.
Van Howe RS. Cost-effective treatment of phimosis. Pediatrics 1998; 102:E43.
Shankar KR, Rickwood AM. The incidence of phimosis in boys. BJU Int 1999; 84:101.
GAIRDNER D. The fate of the foreskin, a study of circumcision. Br Med J 1949; 2:1433.
Steadman B, Ellsworth P. To circ or not to circ: indications, risks, and alternatives to circumcision in the pediatric population with phimosis. Urol Nurs 2006; 26:181.
Zampieri N, Corroppolo M, Camoglio FS, et al. Phimosis: stretching methods with or without application of topical steroids? J Pediatr 2005; 147:705.
Orsola A, Caffaratti J, Garat JM. Conservative treatment of phimosis in children using a topical steroid. Urology 2000; 56:307.
American Academy of Pediatrics Task Force on Circumcision. Male circumcision. Pediatrics 2012; 130:e756.
Metcalfe PD, Elyas R. Foreskin management: Survey of Canadian pediatric urologists. Can Fam Physician 2010; 56:e290.
Moreno G, Corbalán J, Peñaloza B, Pantoja T. Topical corticosteroids for treating phimosis in boys. Cochrane Database Syst Rev 2014; :CD008973.
Sneppen I, Thorup J. Foreskin Morbidity in Uncircumcised Males. Pediatrics 2016; 137.
Letendre J, Barrieras D, Franc-Guimond J, et al. Topical triamcinolone for persistent phimosis. J Urol 2009; 182:1759.
Zavras N, Christianakis E, Mpourikas D, Ereikat K. Conservative treatment of phimosis with fluticasone proprionate 0.05%: a clinical study in 1185 boys. J Pediatr Urol 2009; 5:181.
Palmer LS, Palmer JS. The efficacy of topical betamethasone for treating phimosis: a comparison of two treatment regimens. Urology 2008; 72:68.
Reynard JM, Barua JM. Reduction of paraphimosis the simple way – the Dundee technique. BJU Int 1999; 83:859.
McCollough M, Sharieff GQ. Abdominal surgical emergencies in infants and young children. Emerg Med Clin North Am 2003; 21:909.
Hollowood AD, Sibley GN. Non-painful paraphimosis causing partial amputation. Br J Urol 1997; 80:958.
Raman SR, Kate V, Ananthakrishnan N. Coital paraphimosis causing penile necrosis. Emerg Med J 2008; 25:454.
Gausche M. Genitourinary surgical emergencies. Pediatr Ann 1996; 25:458.
Barone JG, Fleisher MH. Treatment of paraphimosis using the “puncture” technique. Pediatr Emerg Care 1993; 9:298.
Williams JC, Morrison PM, Richardson JR. Paraphimosis in elderly men. Am J Emerg Med 1995; 13:351.
Fariña LA, Alonso MV, Horjales M, Zungri ER. [Contact-derived allergic balanoposthitis and paraphimosis through topical application of celandine juice]. Actas Urol Esp 1999; 23:554.
Dubin J, Davis JE. Penile emergencies. Emerg Med Clin North Am 2011; 29:485.
Chambers P. Paraphimosis reduction. In: Textbook of Pediatric Emergency Procedures, 2nd ed, King C, Henretig FM (Eds), Lippincott, Williams & Wilkins, Philadelphia 2008. p.904.
Cahill D, Rane A. Reduction of paraphimosis with granulated sugar. BJU Int 1999; 83:362.
Choe JM. Paraphimosis: current treatment options. Am Fam Physician 2000; 62:2623.
Olson C. Emergency treatment of paraphimosis. Can Fam Physician 1998; 44:1253.
Turner CD, Kim HL, Cromie WJ. Dorsal band traction for reduction of paraphimosis. Urology 1999; 54:917.
Little B, White M. Treatment options for paraphimosis. Int J Clin Pract 2005; 59:591.
Houghton GR. The “iced-glove” method of treatment of paraphimosis. Br J Surg 1973; 60:876.
Pillai SB, Besner GE. Pediatric testicular problems. Pediatr Clin North Am 1998; 45:813.
Keys C, Heloury Y. Retractile testes: a review of the current literature. J Pediatr Urol 2012; 8:2.
Docimo SG. Testicular descent and ascent in the first year of life. Urology 1996; 48:458.
Schiffer KA, Kogan SJ, Reda EF, Levitt SB. Acquired undescended testes. Am J Dis Child 1987; 141:106.
Gracia J, Navarro E, Guirado F, et al. Spontaneous ascent of the testis. Br J Urol 1997; 79:113.
Hack WW, Meijer RW, Van Der Voort-Doedens LM, et al. Previous testicular position in boys referred for an undescended testis: further explanation of the late orchidopexy enigma? BJU Int 2003; 92:293.
Husmann DA, Levy JB. Current concepts in the pathophysiology of testicular undescent. Urology 1995; 46:267.
Hutson JM. Journal of Pediatric Surgery-Sponsored Fred McLoed Lecture. Undescended testis: the underlying mechanisms and the effects on germ cells that cause infertility and cancer. J Pediatr Surg 2013; 48:903.
Berkowitz GS, Lapinski RH, Dolgin SE, et al. Prevalence and natural history of cryptorchidism. Pediatrics 1993; 92:44.
Ritzén EM, Kollin C. Management of undescended testes: how and when? Pediatr Endocrinol Rev 2009; 7:32.
Boisen KA, Kaleva M, Main KM, et al. Difference in prevalence of congenital cryptorchidism in infants between two Nordic countries. Lancet 2004; 363:1264.
Virtanen HE, Bjerknes R, Cortes D, et al. Cryptorchidism: classification, prevalence and long-term consequences. Acta Paediatr 2007; 96:611.
Nah SA, Yeo CS, How GY, et al. Undescended testis: 513 patients’ characteristics, age at orchidopexy and patterns of referral. Arch Dis Child 2014; 99:401.
Kolon TF, Herndon CD, Baker LA, et al. Evaluation and treatment of cryptorchidism: AUA guideline. J Urol 2014; 192:337.
Penson DF, Krishnaswami S, Jules A, et al. Evaluation and treatment of cryptorchidism. Comparative Effectiveness Review No. 88. AHRQ December 2012.
Tasian GE, Copp HL, Baskin LS. Diagnostic imaging in cryptorchidism: utility, indications, and effectiveness. J Pediatr Surg 2011; 46:2406.
Diamond DA, Chan IHY, Holland AJA, et al. Advances in paediatric urology. Lancet 2017; 390:1061.
Ramage IJ, Schuckett B, McLorie GA, Geary DF. Primary vesicoureteric reflux diagnosed in the 1st month of life. Pediatr Nephrol 1999; 13:716.
Willemsen J, Nijman RJ. Vesicoureteral reflux and videourodynamic studies: results of a prospective study. Urology 2000; 55:939.
Hiraoka M, Hori C, Tsukahara H, et al. Vesicoureteral reflux in male and female neonates as detected by voiding ultrasonography. Kidney Int 1999; 55:1486.
van Eerde AM, Meutgeert MH, de Jong TP, Giltay JC. Vesico-ureteral reflux in children with prenatally detected hydronephrosis: a systematic review. Ultrasound Obstet Gynecol 2007; 29:463.
Skoog SJ, Peters CA, Arant BS Jr, et al. Pediatric Vesicoureteral Reflux Guidelines Panel Summary Report: Clinical Practice Guidelines for Screening Siblings of Children With Vesicoureteral Reflux and Neonates/Infants With Prenatal Hydronephrosis. J Urol 2010; 184:1145.
Hoberman A, Charron M, Hickey RW, et al. Imaging studies after a first febrile urinary tract infection in young children. N Engl J Med 2003; 348:195.
Chand DH, Rhoades T, Poe SA, et al. Incidence and severity of vesicoureteral reflux in children related to age, gender, race and diagnosis. J Urol 2003; 170:1548.
Ismaili K, Hall M, Piepsz A, et al. Primary vesicoureteral reflux detected in neonates with a history of fetal renal pelvis dilatation: a prospective clinical and imaging study. J Pediatr 2006; 148:222.
Upadhyay J, McLorie GA, Bolduc S, et al. Natural history of neonatal reflux associated with prenatal hydronephrosis: long-term results of a prospective study. J Urol 2003; 169:1837.
Keren R, Shaikh N, Pohl H, et al. Risk Factors for Recurrent Urinary Tract Infection and Renal Scarring. Pediatrics 2015; 136:e13.
Mattoo TK, Chesney RW, Greenfield SP, et al. Renal Scarring in the Randomized Intervention for Children with Vesicoureteral Reflux (RIVUR) Trial. Clin J Am Soc Nephrol 2016; 11:54.
Shaikh N, Ewing AL, Bhatnagar S, Hoberman A. Risk of renal scarring in children with a first urinary tract infection: a systematic review. Pediatrics 2010; 126:1084.
Jodal U, Smellie JM, Lax H, Hoyer PF. Ten-year results of randomized treatment of children with severe vesicoureteral reflux. Final report of the International Reflux Study in Children. Pediatr Nephrol 2006; 21:785.
Smellie JM, Barratt TM, Chantler C, et al. Medical versus surgical treatment in children with severe bilateral vesicoureteric reflux and bilateral nephropathy: a randomised trial. Lancet 2001; 357:1329.
Practice parameter: the diagnosis, treatment, and evaluation of the initial urinary tract infection in febrile infants and young children. American Academy of Pediatrics. Committee on Quality Improvement. Subcommittee on Urinary Tract Infection. Pediatrics 1999; 103:843.
Cheng CH, Tsai MH, Huang YC, et al. Antibiotic resistance patterns of community-acquired urinary tract infections in children with vesicoureteral reflux receiving prophylactic antibiotic therapy. Pediatrics 2008; 122:1212.
Cooper CS, Chung BI, Kirsch AJ, et al. The outcome of stopping prophylactic antibiotics in older children with vesicoureteral reflux. J Urol 2000; 163:269.





