Parasitosis: Revisión de las más Importantes en la Práctica Clínica.
Revisamos en esta ocasión las parasitosis más importantes en la práctica clínica, haciendo énfasis en los factores de riesgo, presentación clínica, diagnóstico y tratamiento. La Malaria toma el papel protagónico, al ser la parasitosis más importante en el humano.
Clasificación
| Protozoos | Helmintos |
|---|---|
| Phylum sarcomastigophora (pseudópodos, flagelos): + Sarcodina (pseudópodos): Entamoeba, Acanthamoeba, Naegleria, Balamuthia. + Mastigophora (flagelados): Giardia, Dientamoeba, Trichomonas, Leishmania, Trypanosoma. | Phylum nemathelminthes, nemátodos o gusanos redondos: Enterobius, Trichuris trichiura, Ascaris, Ancylostoma, Strongyloides, Anisakis, Toxocara. Trichinella, Filarias. |
| Phylum apicomplexa (microtúbulos apicales): + Coccidia: Cystoisospora, Cyclospora, Cryptosporidium, Microsporidio, Sarcocystis, Toxoplasma. + Haemosporina: Plasmodium. + Piroplasmia: Babesia. | Phylum platyhelminthes o gusanos planos: + Trematodos o duelas: Fasciola, Schistosoma, Clonorchis, Paragonimus. + Cestodos o tenias: intestinales (T solium, T saginata, Diphyllobothrium latum, Dipylidium caninum, Hymenolepis diminuta); tisulares (Echinococcus granulosus, E. multilocularis). |
| Phylum ciliophora (ciliados): Balantidium coli. |
Leishmaniasis Visceral
La leishmaniasis consiste en un complejo de enfermedades transmitidas por vectores causadas por más de 20 especies del género de protozoos Leishmania y se transmite por vectores, las moscas de arena. Las manifestaciones clínicas varían desde úlceras cutáneas a enfermedad multiorgánica sistémica. La leishmaniasis visceral es causada principalmente por las dos especies relacionadas Leishmania donovani y Leishmania infantum (sinónimo Leishmania chagasi).
Se calcula que cada año se producen de 200,000 a 400,000 nuevos casos de leishmaniasis visceral y de 20,000 a 40,000 muertes por esta entidad. Entre las enfermedades tropicales, la leishmaniasis ocupa el segundo lugar en mortalidad y el cuarto en la pérdida de años de vida ajustados por discapacidad. La leishmaniasis es considerada una de las “enfermedades más olvidadas” dada su fuerte asociación con la pobreza y los recursos limitados invertidos en nuevas herramientas para diagnóstico, tratamiento y control.
En las principales áreas endémicas, las infecciones asintomáticas (medidas por la seroconversión y/o la prueba cutánea de leishmanina) superan en número a la enfermedad clínicamente manifiesta. La seroconversión refleja una infección recién adquirida, pero puede preceder al inicio de la leishmaniasis visceral clínica por meses. El mejor medio para la detección de inmunidad es la prueba cutánea de leishmanina (LST), que refleja una inmunidad celular no permanente. Las personas con LST positiva tienen 95% menos riesgo de leishmaniasis visceral en comparación con aquellas con LST negativa.
Transmisión
Los vectores de la leishmaniasis visceral son las moscas de arena e incluyen más de 10 especies del género Phlebotomus y Lutzomyia longipalpis. La mosca de arena hembra es hematófaga; ambos sexos se alimentan de azúcar de fuentes vegetales. La leishmaniasis también se puede transmitir a través del uso de drogas intravenosas, transfusiones de sangre, trasplantes de órganos, infección congénita y accidentes de laboratorio. Estos otros modos de transmisión son raros.
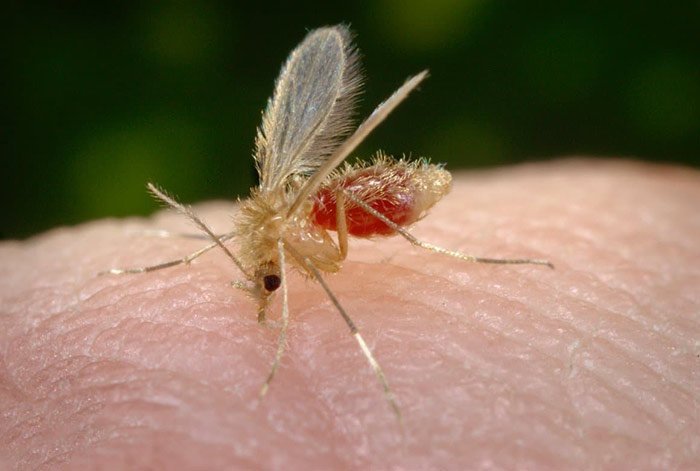
Presentación Clínica
Muchos de los casos de leishmaniasis son asintomáticos, lo que refleja la capacidad del sistema inmunológico del hospedero para controlar al parásito. La proporción de infección asintomática vs. enfermedad clínicamente manifiesta varía ampliamente, desde > 30: 1 en Europa a 6:1 en niños brasileños y 4:1 en Bangladesh. Esto puede reflejar diferencias en la virulencia del parásito, la predisposición genética humana, el estado nutricional y otros factores.
Las infecciones subclínicas pueden detectarse de manera temprana con pruebas serológicas. El desarrollo posterior de una respuesta inmune celular se puede detectar a través de la prueba cutánea de leishmania o intradermorreacción de Montenegro. La mayoría de los pacientes con infección subclínica albergan parásitos viables de por vida y pueden desarrollar una enfermedad de reactivación si se produce inmunosupresión; no parece haber eficacia en la profilaxis primaria.
Kala-Azar
Kala-azar (“fiebre negra”) es la presentación más grave de la infección por Leishmania, el nombre hace referencia al oscurecimiento de la piel, que es un síntoma común en el sur de Asia, pero no en otros lugares. Esto parece haber sido más común en las descripciones clásicas de la enfermedad de principios del siglo XX, pero también se ha reportado en series de casos más recientes. El período de incubación suele ser de dos a seis meses, pero puede variar desde algunas semanas hasta varios años. El inicio de los síntomas suele ser insidioso o subagudo, con progresión lenta de malestar general, fiebre, pérdida de peso y esplenomegalia (con o sin hepatomegalia) durante un período de meses. En casos raros, la enfermedad febril aguda puede ocurrir con síntomas rápidamente progresivos.
Los pacientes pueden quejarse de malestar abdominal en el cuadrante superior izquierdo. El bazo suele estar firme y mínimamente doloroso, aunque en algunos pacientes la palpación es bastante dolorosa, debido a la presión capsular producida por un agrandamiento rápido. La hepatomegalia suele ser menos marcada que la esplenomegalia. Se puede observar linfadenopatía en la leishmaniasis visceral de África oriental, pero es rara fuera de esta región. Dado que los parásitos se replican en el sistema reticuloendotelial, se acumulan elevadas cargas de parásitos en el bazo, el hígado y la médula ósea.
Puede ocurrir anemia grave debido a la supresión medular ósea, la hemólisis y el secuestro esplénico. El kala-azar avanzado se asocia con marcada caquexia, hipoalbuminemia y edema. Más adelante en el curso de la enfermedad, pueden aparecer disfunción hepática, ictericia y ascitis. La trombocitopenia y la disfunción hepática contribuyen a las complicaciones hemorrágicas. Los pacientes pueden tener hemorragia espontánea de las encías, la mucosa nasal u otros sitios. En raras ocasiones, la diarrea crónica y la malabsorción pueden ocurrir como resultado de la invasión parasitaria del intestino.
Esta entidad casi siempre es letal sin tratamiento. Incluso con tratamiento, las tasas de mortalidad pueden ser del 10% o más. La ictericia, la emaciación, la anemia severa y la coinfección por VIH se asocian con una mayor mortalidad. La tríada de VIH, leishmaniasis visceral y tuberculosis se reporta cada vez más en India y Etiopía. La coinfección por tuberculosis también aumenta la mortalidad por leishmaniasis, incluso en ausencia del VIH. La inmunosupresión aumenta el riesgo de infecciones bacterianas secundarias. Por último, el Kala-azar durante el embarazo puede provocar un aborto espontáneo o leishmaniasis congénita.
Diagnóstico
Los métodos de diagnóstico para establecer el diagnóstico de leishmaniasis visceral incluyen la visualización del amastigote característico en frotis o tejido (histopatología), aislamiento del parásito mediante cultivo in vitro, detección molecular del ADN del parásito y pruebas serológicas. Las pruebas serológicas están indicadas en pacientes con sospecha de leishmaniasis visceral y resultados negativos o no concluyentes para histopatología, cultivo y pruebas moleculares.
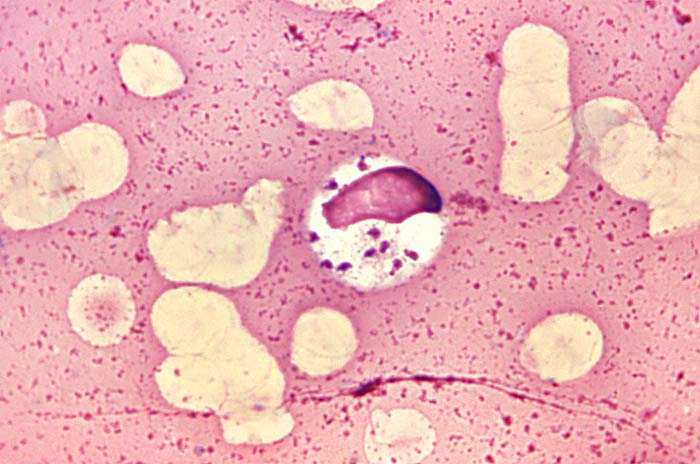
El diagnóstico definitivo requiere la demostración del parásito por frotis o cultivo del tejido (generalmente médula ósea o bazo). La utilidad de las herramientas de diagnóstico menos invasivas (como la demostración de anticuerpos específicos, antígenos o ADN del parásito en muestras de sangre periférica) depende del estado clínico del paciente, el origen geográfico del parásito, los métodos empleados y la experiencia de laboratorio. En pacientes con infección por VIH, la sensibilidad de las pruebas serológicas disminuye; en estos pacientes, las cargas parasitarias son muy elevadas, lo que aumenta la sensibilidad del cultivo y los ensayos moleculares en sangre periférica.
Tratamiento
Los agentes con eficacia contra la leishmaniasis visceral incluyen anfotericina B, fármacos antimoniales pentavalentes, paromomicina (un aminoglucósido parenteral) y miltefosina (el primer fármaco oral para el tratamiento de la leishmaniasis visceral). La anfotericina B liposomal es el fármaco con la mayor eficacia terapéutica y el perfil de seguridad más favorable; la monoterapia (dosis total de 20 a 21 mg/kg) con este agente es el tratamiento de elección en Europa, América del Norte y América del Sur. La anfotericina B convencional tiene una alta eficacia antileishmania, pero se asocia con un alto riesgo de toxicidad renal y otros efectos secundarios.
Giardia lamblia
Giardia duodenalis (también conocido como G. lamblia o G. intestinalis) es un parásito protozoario capaz de causar enfermedades diarreicas esporádicas o epidémicas. La giardiasis es una causa importante de enfermedades transmitidas por el agua y alimentos, brotes en guarderías infantiles, asilos y enfermedades en viajeros internacionales. La infección por G. duodenalis ocurre en todo el mundo. Los grupos de alto riesgo incluyen bebés y niños pequeños adoptados internacionalmente, viajeros, personas inmunocomprometidas y pacientes con fibrosis quística.
La giardiasis es especialmente común en áreas con malas condiciones sanitarias y con instalaciones limitadas de tratamiento de agua. En entornos de recursos limitados, se ha informado que la prevalencia de la giardiasis es tan alta como del 20 al 40%. Las tasas más altas de infección en áreas de recursos limitados ocurren en niños <5 años. Muchas personas con G. duodenalis identificadas en muestras de heces están asintomáticas. La transmisión de quistes infecciosos de Giardia a humanos puede ocurrir a través de tres vías: el agua, los alimentos o fecal-oral.
Ciclo Biológico
Las especies de Giardia tienen dos formas morfológicas: quistes y trofozoítos. Los quistes son la forma infecciosa del parásito, se excretan en las heces y pueden sobrevivir en ambientes húmedos durante períodos prolongados. Después de la ingestión del quiste, la exquistación ocurre en el intestino delgado proximal con liberación de trofozoítos. Éstos últimos tienen forma de pera, son binucleados y capaces de dividirse por fisión binaria; se localizan principalmente en el intestino delgado proximal. Un disco adhesivo en la superficie ventral del trofozoito facilita su unión a la superficie de la mucosa del duodeno y el yeyuno, aunque no invade el epitelio de la mucosa.
Los trofozoítos que no se adhieren al intestino delgado avanzan hacia el intestino grueso, donde vuelven a la forma del quiste infeccioso; las sales biliares conjugadas parecen favorecer la enquistación. Los quistes se devuelven al medio ambiente en las heces excretadas; en el contexto de la diarrea, los trofozoítos también se pueden encontrar en las heces. Después de la ingestión del quiste, la infección tiene una incubación de una semana o más antes de que los síntomas de la giardiasis aguda puedan desarrollarse.

Presentación Clínica
La gravedad de las manifestaciones clínicas asociadas con la giardiasis es variable. En general, aproximadamente la mitad de las personas expuestas eliminan la infección en ausencia de síntomas clínicos, aproximadamente el 15% eliminan los quistes de forma asintomática, y el 35 a 45% restante tiene una infección sintomática. La naturaleza de las manifestaciones clínicas en un individuo probablemente depende de una serie de factores que incluyen la virulencia del patógeno aislado, la carga parasitaria y la respuesta inmune del huésped.
La infección asintomática ocurre tanto en niños como en adultos, y el quiste asintomático puede durar seis meses o más. Se ha observado que en entornos de recursos limitados, la mayoría de los niños han estado expuestos a Giardia a la edad de dos años sin que se asocie con diarrea; sin embargo, pueden tener problemas de crecimiento. Los síntomas de la giardiasis aguda incluyen:
- Diarrea: 90%
- Malestar general: 86%
- Heces fétidas y grasas (esteatorrea): 75%
- Cólicos y distensión abdominal: 71%
- Flatulencia: 75%
- Náuseas: 69%
- Pérdida de peso: 66%
- Vómitos: 23%
- Fiebre: 15%
- Estreñimiento: 13%
- Urticaria: 10%
Los síntomas generalmente se desarrollan después de un período de incubación de 7 a 14 días. El inicio de los síntomas gastrointestinales agudos dentro de la semana posterior a la exposición probablemente no sea atribuible a la infección por Giardia. Los síntomas pueden durar de dos a cuatro semanas.
Giardiasis Crónica
La giardiasis crónica puede seguir a la fase aguda de la enfermedad o desarrollarse en ausencia de una enfermedad aguda previa. Los síntomas crónicos pueden desarrollarse hasta en la mitad de las personas sintomáticas. En un estudio de individuos infectados experimentalmente, el 84% tenía una enfermedad autolimitada (duración media de 18 días); el resto se infectó crónicamente. Los síntomas de la giardiasis crónica pueden incluir:
- Heces sueltas, pero generalmente sin diarrea
- Esteatorrea
- Pérdida de peso importante (10 a 20% del peso corporal)
- Malabsorción
- Malestar
- Fatiga
- Depresión
- Cólicos abdominales
- Borborigmos
- Flatulencia
- Eructos
Las manifestaciones pueden ondular durante muchos meses. La malabsorción puede ser responsable de la pérdida de peso importante que puede ocurrir en la giardiasis. Incluso en casos de infección asintomática, puede producirse una mala absorción de grasas, azúcares, carbohidratos y vitaminas. Esto puede conducir a hipoalbuminemia y deficiencias de vitamina A, B12 y ácido fólico. La intolerancia a la lactosa adquirida ocurre en hasta 40% de los pacientes; clínicamente, esto se manifiesta con una exacerbación de los síntomas intestinales después de la ingestión de productos lácteos. La recuperación puede tomar muchas semanas, incluso después de la eliminación del parásito.
Diagnóstico
Las herramientas para el diagnóstico de giardiasis incluyen pruebas de detección de antígenos, análisis de detección de ácido nucleico y coprológico. En áreas donde están disponibles, se prefieren las pruebas de detección de antígenos o ácidos nucleicos sobre el coprológico. La microscopía para detectar Giardia puede ser específica y también útil para identificar otras posibles causas parasitarias de los síntomas gastrointestinales. Las limitaciones incluyen la excreción intermitente de quistes de Giardia (que requieren hasta tres muestras), largo procesamiento y experiencia técnica.
Se han desarrollado varios inmunoensayos que usan anticuerpos contra los antígenos del quiste o trofozoítos para el análisis de heces. Los kits disponibles incluyen ensayos de inmunofluorescencia directa que usan anticuerpos monoclonales marcados con fluoresceína, ensayos inmunocromatográficos y ensayos inmunoabsorbentes ligados a enzimas (ELISA). En general, estos métodos tienen una mayor sensibilidad y un tiempo de respuesta más rápido que los métodos de microscopía de heces convencionales.
La especificidad y el costo suelen ser relativamente comparables. Algunos estudios han demostrado que la inmunofluorescencia directa tiene la sensibilidad más alta. Muchos de los ensayos disponibles comercialmente pueden detectar tanto Giardia como Cryptosporidium simultáneamente.
Tratamiento
Los fármacos de elección para el tratamiento inicial de giardiasis incluyen metronidazol, tinidazol y nitazoxanida. Para el tratamiento de pacientes ≥3 años de edad, es preferible el tinidazol ya que tiene una vida media más larga que la nitazoxanida y puede administrarse en dosis única con alta eficacia (>90%). Para el tratamiento de pacientes de 12 a 36 meses de edad, se recomienda la nitazoxanida. Dada la información limitada sobre el uso de tinidazol y nitazoxanida para pacientes <12 meses de edad, se recomienda el metronidazol para estos pacientes.
Se ha observado resistencia a los antimicrobianos hasta en un 20% de los aislamientos de Giardia, y se ha observado resistencia cruzada entre el tinidazol y el metronidazol (ambos son nitroimidazoles). La prueba de resistencia antimicrobiana no está disponible de forma rutinaria en la mayoría de los entornos clínicos. En general, la presencia de síntomas persistentes o recurrentes debe suscitar sospechas de resistencia a antimicrobianos.
Para el tratamiento de mujeres embarazadas con giardiasis leve en quienes se puede mantener la hidratación y la nutrición, es preferible retrasar el tratamiento hasta al menos el segundo trimestre para minimizar la probabilidad de efectos adversos del medicamento en el feto. Si el tratamiento es necesario durante el primer trimestre, se recomienda la paromomicina ya que está asociada a una absorción sistémica limitada. Durante el segundo y tercer trimestres, los agentes antimicrobianos incluyen paromomicina, tinidazol, nitazoxanida o metronidazol.
Amebiasis
La amebiasis intestinal es causada por el protozoo Entamoeba histolytica. La mayoría de las infecciones son asintomáticas; las manifestaciones clínicas incluyen disentería amebiana y enfermedad extraintestinal. En todo el mundo, aproximadamente 50 millones de personas desarrollan colitis o enfermedad extraintestinal, con más de 100,000 muertes al año. La amebiasis ocurre en todo el mundo; la prevalencia aumenta desproporcionadamente en los países en desarrollo debido a las malas condiciones socioeconómicas y los niveles de saneamiento.
Las áreas con altas tasas de infección amebiana incluyen India, África, México y partes de América Central y del Sur. La prevalencia general de la infección amebiana puede llegar al 50% en algunas áreas. El parásito existe en dos formas, una etapa de quiste (la forma infecciosa) y una etapa de trofozoíto (la forma que causa la enfermedad invasiva). La infección ocurre después de la ingestión de quistes amebianos; esto es usualmente a través de alimentos o agua contaminados pero puede estar asociado con la transmisión venérea a través del contacto fecal-oral.
Los quistes pueden permanecer viables en el ambiente durante semanas o meses, y la ingestión de un solo quiste es suficiente para causar la enfermedad. Los quistes pasan a través del estómago hasta el intestino delgado, donde forman trofozoítos. Estos últimos pueden invadir y penetrar la mucosa del colon, causando la destrucción del tejido y el aumento de la secreción intestinal y, por tanto, conducir a la diarrea sanguinolenta.
Presentación Clínica
La mayoría de las infecciones por Entamoeba son asintomáticas; esto incluye el 90% de las infecciones por E. histolytica. Los factores que influyen en el desarrollo de enfermedad invasiva incluyen la cepa de E. histolytica y los factores del huésped tales como susceptibilidad genética, la edad y el estado inmunológico. Los factores de riesgo para la enfermedad grave y el aumento de la mortalidad incluyen la edad joven, el embarazo, tratamiento con corticosteroides, neoplasias, malnutrición y alcoholismo.
La amebiasis clínica generalmente tiene un inicio subagudo, de una a tres semanas. Los síntomas van desde diarrea leve a disentería grave, produciendo dolor abdominal (12 a 80%), diarrea (94 a 100%) y sangre en heces (94 a 100%), hasta colitis amebiana fulminante. La pérdida de peso ocurre en aproximadamente la mitad de los pacientes, y la fiebre hasta en un 38%. La disentería amebiana es la diarrea con sangre y moco visibles en heces y presencia de trofozoítos hematófagos (trofozoítos con glóbulos rojos ingeridos).
La colitis fulminante con necrosis intestinal que conduce a la perforación, y peritonitis se ha observado en aproximadamente el 0.5% de los casos; la tasa de mortalidad asociada es más del 40%; puede desarrollarse megacolon tóxico. La colitis amebiana ha sido identificada también en pacientes asintomáticos. En raras ocasiones, la amebiasis intestinal puede presentarse como un síndrome crónico de diarrea, pérdida de peso y dolor abdominal sin disentería, que dura años e imita a la enfermedad inflamatoria intestinal.
Absceso hepático amebiano
La infección se puede diseminar al hígado desde el colon por vía hematógena, provocando la formación de un absceso, de contenido achocolatado. La clínica del absceso hepático amebiano es aguda con fiebre (38.5ºc a 39.5ºC) durante una a dos semanas, así como dolor en hipocondrio derecho y hepatomegalia. Presenta además leucocitosis moderada y anemia, mientras que la fosfatasa alcalina y las transaminasas hepáticas se encuentran elevadas.
Ameboma
En raras ocasiones, puede ocurrir una infección colónica localizada que resulta en una masa de tejido de granulación, dando lugar al ameboma e imitando al cáncer de colon. Los pacientes con amebomas generalmente tienen una masa palpable dolorosa. Otras complicaciones raras de la amebiasis incluyen la amebiasis cutánea perianal y las fístulas rectovaginales.
Diagnóstico
Las técnicas de diagnóstico incluyen microscopía, detección de antígeno, serología, técnicas moleculares y colonoscopia con examen histológico. Las técnicas de cultivo están limitadas a entornos de investigación. El diagnóstico se logra de manera óptima mediante la combinación de pruebas de serología o antígeno junto con la identificación del parásito en heces o sitios extraintestinales. La demostración de quistes o trofozoítos en las heces sugiere una amebiasis intestinal, pero la microscopía no puede diferenciar entre E. histolytica y E. dispar o E. moshkovskii. Además, este estudio requiere experiencia especializada y está sujeta a errores del operador.
La excreción del organismo puede variar, por lo que se debe enviar un mínimo de tres muestras en días separados para detectar del 85 al 95% de las infecciones. Las muestras se pueden concentrar y teñir con yodo para detectar quistes. Para buscar trofozoítos, se debe realizar una preparación en fresco con solución salina y un frotis teñido con hematoxilina de hierro y/o tricrómico de Wheatley; la fijación con alcohol polivinílico para la tinción a menudo es útil. La PCR es considerablemente más sensible que la microscopía y es 100% específica para E. histolytica. En el absceso amebiano, es de utilidad el ultrasonido hepático, además de la serología, ésta última con sensibilidad del 90% a partir de la primera semana.
Serología
La infección por E. histolytica produce el desarrollo de anticuerpos; la infección por E. dispar no. Los anticuerpos son detectables dentro de los cinco a siete días posteriores a la infección aguda y pueden persistir durante años. Aproximadamente del 10 al 35% de las personas no infectadas en áreas endémicas tienen anticuerpos debido a una infección previa por E. histolytica. Por tanto, la serología negativa es útil para la exclusión de la enfermedad, pero la serología positiva no puede distinguir entre infección aguda y previa.
La hemaglutinación indirecta es la prueba serológica más sensible en amebiasis; es positiva en aproximadamente el 90% de los pacientes con infección intestinal sintomática. La difusión de gel de agar y la contrainmunoforesis son menos sensibles y generalmente permanecen positivas durante sólo 6 a 12 meses, lo que las hace de mayor utilidad en áreas endémicas. También se ha desarrollado un ELISA comercialmente disponible con una sensibilidad del 93%.
Tratamiento
La colitis invasiva generalmente se trata con metronidazol, seguido de un agente intraluminal (como p.e. paromomicina o iodoquinol) para eliminar los quistes intraluminales. Un ciclo de 10 días de metronidazol elimina la infección intraluminal en muchos casos, pero un segundo amebicida intraluminal sigue estando justificado. Los pacientes asintomáticos con infección por E. histolytica deben tratarse con un agente intraluminal únicamente. La dosis de metronidazol es de 500 a 750 mg por vía oral tres veces al día durante 7 a 10 días en adultos y 35 a 50 mg/kg por día en tres dosis divididas durante 7 a 10 días en niños.
Por lo general, no se recomienda una duración más corta del tratamiento con metronidazol. Este fármaco se absorbe bien en el tracto gastrointestinal; el tratamiento IV. no ofrece ninguna ventaja importante, siempre y cuando el paciente pueda ingerir medicamentos por vía oral y no tenga una alteración importante en la absorción del intestino delgado. Las alternativas al metronidazol incluyen tinidazol y ornidazol. El tinidazol (2 gr. por vía oral por día durante tres días) tiene una tasa de curación del 90 al 93%. El absceso amebiano no requiere drenaje quirúrgico o percutáneo en la mayoría de los casos, siendo efectivo el tratamiento médico.
Otras Parasitosis
| Parasitosis | Clínica y Dx. | Tratamiento |
|---|---|---|
| Tripanosomiasis por Trypanosoma cruzi (Enfermedad de Chagas) | Transmisión por heces de chinches. Lesión inflamatoria en sitio de entrada, adenopatía regional; en cara ocasiona el signo de Romaña edema ocular y periocular. La enf. crónica cursa con cardiomiopatía dilatada (más frecuente), megaesófago y megacolon. Diagnóstico mediante examen microscópico de sangre fresca o PCR (si no se identifica el tripomastigote en microscopía) en enf. aguda, serología en la crónica. | Benznidazol, de mayor eficacia y mejor tolerancia en niños, o nifurtimox |
| Tripanosomiasis por Trypanosoma brucei | Causa la enfermedad del sueño, transmitida por la mosca tsé-tsé. Cursa inicialmente con fiebre, adenopatía y esplenomegalia, posteriormente encefalitis. Dx. mediante demostración del parásito en sangre, tejidos o LCR mediante tinción de Giemsa; serología. | Suramina, pentamidina, eflornitina, melarsoprol. |
| Babesiosis por Babesia microti | Transmitida por garrapatas. Infección eritrocitaria con clínica parecida a la malaria. Forma grave en pacientes esplenectomizados. Dx. mediante visualización con tinción de Giemsa de sangre periférica, serología o PCR. | Atovacuona más azitromicina o quinina más clindamicina. |
| Teniasis por Taenia solium (cerdo) y T. saginata (ganado bovino). | Infección por consumo de carne contaminada con quistes. Cuadro clínico inespecífico y diagnóstico mediante observación de huevos en heces. Taenia solium ocasiona cisticercosis con enquistación en músculo y cerebro, pudiendo provocar convulsiones. | Albendazol o praziquantel. |
| Ascariasis por Ascaris lumbricoides | Helmintiasis más frecuente a nivel mundial. Morbimortalidad por obstrucción intestinal y de vías biliares. En infecciones con pocos nematodos, el cuadro es vago, con dolor abdominal, diarrea o anorexia. En carga parasitaria alta, se asocia a dolor y distensión abdominal, náusea, vómito, disminución del peristaltismo. Dx. mediante identificación del nematodo adulto al ser eliminado por el recto y hallazgo de huevos en heces. | Albendazol. |
| Oxiuriasis o enterobiasis por Enterobius vermicularis. | Se transmite por vía fecal-oral, y ocasiona prurito anal y perineal, de predominio vespertino, y bruxismo (rechinar de dientes). Diagnóstico mediante visualización de los huevos del parásito en una cinta adhesiva transparente aplicada a los márgenes del ano (test de Graham). | Mebendazol, albendazol o pamoato de pirantel. |
| Estrongiloidiasis por Strongyloides stercoralis. | Causa infección pulmonar con infiltrados, eosinofilia y afección intestinal con diarreas. En pacientes inmunosuprimidos ocurre una replicación descontrolada del parásito e invasión de las larvas en el SNC. Ello provoca sepsis, meningitis o peritonitis por bacilos gramnegativos, por contaminación mediante tejidos arrastrados por la larva. | Ivermectina |
| Triquinosis por Trichinella spiralis | Infección tras ingesta de carne de cerdo poco cocinada o derivados contaminados con larvas. El humano es huésped accidental. El cuadro inicia con manifestaciones intestinales, seguidas de síntomas musculares (por invasión de dicho tejido) con fiebre, mialgias, edema periorbitario, hemorragias conjuntivales y, en ocasiones, miocarditis con eosinofilia. CPK elevada. Dx. mediante serología o biopsia muscular. | Albendazol más prednisona. |
| Anquilostomiasis por Ancylostoma duodenale y Necator americanus | En su mayoría cursa asintomática, con anemia ferropénica e hipoproteinemia en pacientes malnutridos. | Albendazol o mebendazol. |
| Hidatidosis por Echinococcus granulosus y E. multilocularis. | Los perros son los huéspedes definitivos, eliminando huevos embrionados en heces y parasitando a ganado, ovejas, roedores y al humano. La mayoría de infecciones en niños al ingerir material contaminado. La taenia penetra el intestino y llega al hígado por vía portal, desde donde pasa a pulmones y otros órganos. Afectación hepática del lóbulo derecho en 70%. El cuadro clínico es inespecífico, las complicaciones poco frecuentes. Dx. mediante prueba de aglutinación indirecta, positiva en el 85% de los casos. Test de Casoni es positivo en 90% de los casos, positivo posterior a extirpación del quiste. IgG4 es marcador más específico. | Punción guiada por ecografía y aspiración de los quistes con inyección forma de"pellejos de uva· (vómica). de alcohol o salino hipertónico (técnica PAIR). Tratamiento simultáneo con albendazol. |
| Fasciola hepatica | Por ingestión de berros silvestres o agua contaminada. Ocasiona fiebre y cuadro digestivo y hepático, con dolor en hipocondrio derecho, hepatomegalia y colangitis esclerosante, marcada eosinofilia. Dx. mediante serología o detección directa del parásito en heces. | Triclabendazol |
| Filariasis | Wuchereria bancrofti y Brugia malayi: filariasis linfáticas, por la picadura de mosquito. Clínicamente cursan con elefantiasis, W bancrofti con linfedema perineal y genital, y B. malayi con linfedema en miembros inferiores. Dx. mediante la visualización de microfilarias en sangre extraída a media noche. Onchocerca volvulus: filariasis cutánea, por picadura de moscas del género simulium. Cuadro cutáneo con prurito, despigmentación cutánea y eosinofilia, provoca ceguera por queratitis y coriorretinitis ("ceguera de los ríos"). Dx. con demostración de la filaria adulta en nódulos subcutáneos, o de las microfilarias en la dermis. Loa loa: filariasis cutánea, por picadura de tábano del género Chrysops. Cursa con episodios de edema migratorio subcutáneo ("edema de Calabar"), eosinofilia y conjuntivitis (migración por el ojo de la forma adulta del nemátodo). Dx. por demostración de microfilarias en sangre extraída a mediodía, o de filaria adulta en conjuntiva. Mansonella perstans: filariasis de cavidades, por picadura de mosquitos. Provoca cuadros de serositis. Dx. al identificar microfilarias en sangre con extracción de la misma a cualquier hora del día, aunque son más abundantes por la noche. | Dietilcarbamacina o ivermectina |
| Clonorquiasis por Clonorchis sinensis | Por ingestión de pescado contaminado y endémica en Sudeste Asiático. Parasita la vía biliar y puede ocasionar colangiocarcinoma a largo plazo. Dx. por examen en heces o bilis de aspirado duodenal. | Praziquantel |
| Esquistosomiasis por Schistosoma mansoni | Endémica en el África subsahariana y Oriente Medio, cursa con cuadros de fibrosis periportal con hipertensión portal y pulmonar. S. haematobium produce parasitación de la vejiga urinaria, con riesgo de carcinoma vesical de células escamosas (a diferencia del transicional en los demás tipos de CA. vesical). Dx. por estudio de heces u orina. | Praziquantel |
| Anisakiasis por Anisakis simplex | Posterior a la ingesta de pescado marinado, parasita la pared gástrica y cursa con dolor abdominal, náuseas y vómitos en 12 a 48 hrs. En ocasiones cursa con lesión pseudotumoral, con clínica de obstrucción intestinal y manifestaciones alérgicas. El humano es huésped accidental. Dx. y tratamiento mediante endoscopia. | Mediante endoscopia. |
Referencias Bibliográficas
Jeronimo SMB, de Queiroz Sousa A, Pearson RD. Leishmaniasis. In: Tropical Infectious Diseases: Principles, Pathogens and Practice, 3rd ed, Guerrant RL, Walker DH, Weller PF (Eds), Saunders Elsevier, Philadelphia 2011. p.696.
World Health Organization. Control of the Leishmaniases: Report of the WHO Expert Committee Meeting, Geneva. March 22-26, 2010. WHO Technical Report Series 2010; 949:1.
Alvar J, Vélez ID, Bern C, et al. Leishmaniasis worldwide and global estimates of its incidence. PLoS One 2012; 7:e35671.
Quinnell RJ, Courtenay O. Transmission, reservoir hosts and control of zoonotic visceral leishmaniasis. Parasitology 2009; 136:1915.
Killick-Kendrick R. The race to discover the insect vector of kala-azar: a great saga of tropical medicine 1903-1942. Bull Soc Pathol Exot 2013; 106:131.
Molina R, Ghosh D, Carrillo E, et al. Infectivity of Post-Kala-azar Dermal Leishmaniasis Patients to Sand Flies: Revisiting a Proof of Concept in the Context of the Kala-azar Elimination Program in the Indian Subcontinent. Clin Infect Dis 2017; 65:150.
Cameron MM, Acosta-Serrano A, Bern C, et al. Understanding the transmission dynamics of Leishmania donovani to provide robust evidence for interventions to eliminate visceral leishmaniasis in Bihar, India. Parasit Vectors 2016; 9:25.
Magill AJ. Visceral leishmaniasis (kala-azar). In: Hunter’s Tropical Medicine and Emerging Infectious Diseases, 8th ed, Strickland GT (Ed), W.B.Saunders Company, Philadelphia 2000. p.670.
Andrade TM, Carvalho EM, Rocha H. Bacterial infections in patients with visceral leishmaniasis. J Infect Dis 1990; 162:1354.
Pagliano P, Carannante N, Rossi M, et al. Visceral leishmaniasis in pregnancy: a case series and a systematic review of the literature. J Antimicrob Chemother 2005; 55:229.
Desjeux P. Leishmaniasis. Public health aspects and control. Clin Dermatol 1996; 14:417.
Sen Gupta PC. History of kala-azar in India. Indian Medical Gazette 1947; 82:281.
Feng Y, Xiao L. Zoonotic potential and molecular epidemiology of Giardia species and giardiasis. Clin Microbiol Rev 2011; 24:110.
Takaoka K, Gourtsoyannis Y, Hart JD, et al. Incidence rate and risk factors for giardiasis and strongyloidiasis in returning UK travellers. J Travel Med 2016; 23.
Roberts DM, Craft JC, Mather FJ, et al. Prevalence of giardiasis in patients with cystic fibrosis. J Pediatr 1988; 112:555.
Muhsen K, Levine MM. A systematic review and meta-analysis of the association between Giardia lamblia and endemic pediatric diarrhea in developing countries. Clin Infect Dis 2012; 55 Suppl 4:S271.
Sahagún J, Clavel A, Goñi P, et al. Correlation between the presence of symptoms and the Giardia duodenalis genotype. Eur J Clin Microbiol Infect Dis 2008; 27:81.
Gilman RH, Brown KH, Visvesvara GS, et al. Epidemiology and serology of Giardia lamblia in a developing country: Bangladesh. Trans R Soc Trop Med Hyg 1985; 79:469.
Istre GR, Dunlop TS, Gaspard GB, Hopkins RS. Waterborne giardiasis at a mountain resort: evidence for acquired immunity. Am J Public Health 1984; 74:602.
Gunasekaran TS, Hassall E. Giardiasis mimicking inflammatory bowel disease. J Pediatr 1992; 120:424.
Duplessis CA, Gutierrez RL, Porter CK. Review: chronic and persistent diarrhea with a focus in the returning traveler. Trop Dis Travel Med Vaccines 2017; 3:9.
Botero-Garcés JH, García-Montoya GM, Grisales-Patiño D, et al. Giardia intestinalis and nutritional status in children participating in the complementary nutrition program, Antioquia, Colombia, May to October 2006. Rev Inst Med Trop Sao Paulo 2009; 51:155.
Prado MS, Cairncross S, Strina A, et al. Asymptomatic giardiasis and growth in young children; a longitudinal study in Salvador, Brazil. Parasitology 2005; 131:51.
Aziz H, Beck CE, Lux MF, Hudson MJ. A comparison study of different methods used in the detection of Giardia lamblia. Clin Lab Sci 2001; 14:150.
Vasoo S, Pritt BS. Molecular diagnostics and parasitic disease. Clin Lab Med 2013; 33:461.
Boadi S, Polley SD, Kilburn S, et al. A critical assessment of two real-time PCR assays targeting the (SSU) rRNA and gdh genes for the molecular identification of Giardia intestinalis in a clinical laboratory. J Clin Pathol 2014; 67:811.
Buss SN, Leber A, Chapin K, et al. Multicenter evaluation of the BioFire FilmArray gastrointestinal panel for etiologic diagnosis of infectious gastroenteritis. J Clin Microbiol 2015; 53:915.
Gardner TB, Hill DR. Treatment of giardiasis. Clin Microbiol Rev 2001; 14:114.
Bartlett AV, Englender SJ, Jarvis BA, et al. Controlled trial of Giardia lamblia: control strategies in day care centers. Am J Public Health 1991; 81:1001.
American Academy of Pediatrics. Red Book: 2018 Report of the Committee on Infectious Diseases, 31st ed, Kimberlin DW, Brady MT, Jackson MA, Long SS (Eds), American Academy of Pediatrics, Itasca, IL 2018.
Nash TE, Ohl CA, Thomas E, et al. Treatment of patients with refractory giardiasis. Clin Infect Dis 2001; 33:22.
van den Bijllaardt W, Overdevest IT, Buiting AG, Verweij JJ. Rapid clearance of Giardia lamblia DNA from the gut after successful treatment. Clin Microbiol Infect 2014; 20:O972.
Shane AL, Mody RK, Crump JA, et al. 2017 Infectious Diseases Society of America Clinical Practice Guidelines for the Diagnosis and Management of Infectious Diarrhea. Clin Infect Dis 2017; 65:e45.
Haque R, Huston CD, Hughes M, et al. Amebiasis. N Engl J Med 2003; 348:1565.
Bercu TE, Petri WA, Behm JW. Amebic colitis: new insights into pathogenesis and treatment. Curr Gastroenterol Rep 2007; 9:429.
Peterson KM, Singh U, Petri WA Jr. Enteric Amebiasis. In: Tropical Infectious Diseases: Principles, Pathogens and Practice, 3rd ed, Guerrant R, Walker DH, Weller PF (Eds), Saunders Elsevier, Philadelphia 2011. p.614.
Parija SC, Mandal J, Ponnambath DK. Laboratory methods of identification of Entamoeba histolytica and its differentiation from look-alike Entamoeba spp. Trop Parasitol 2014; 4:90.
Rayan HZ. Microscopic overdiagnosis of intestinal amoebiasis. J Egypt Soc Parasitol 2005; 35:941.
González-Ruíz A, Haque R, Rehman T, et al. Further diagnostic use of an invasive-specific monoclonal antibody against Entamoeba histolytica. Arch Med Res 1992; 23:281.
Haque R, Kress K, Wood S, et al. Diagnosis of pathogenic Entamoeba histolytica infection using a stool ELISA based on monoclonal antibodies to the galactose-specific adhesin. J Infect Dis 1993; 167:247.
Haque R, Ali IK, Akther S, Petri WA Jr. Comparison of PCR, isoenzyme analysis, and antigen detection for diagnosis of Entamoeba histolytica infection. J Clin Microbiol 1998; 36:449.
Spadafora LJ, Kearney MR, Siddique A, et al. Species-Specific Immunodetection of an Entamoeba histolytica Cyst Wall Protein. PLoS Negl Trop Dis 2016; 10:e0004697.
Haque R, Petri WA Jr. Diagnosis of amebiasis in Bangladesh. Arch Med Res 2006; 37:273.
Cooper CJ, Fleming R, Boman DA, Zuckerman MJ. Varied Clinical Manifestations of Amebic Colitis. South Med J 2015; 108:676.
Horiki N, Furukawa K, Kitade T, et al. Endoscopic findings and lesion distribution in amebic colitis. J Infect Chemother 2015; 21:444.
Drugs for Parasitic Infections, 3rd ed, The Medical Letter, New Rochelle, NY 2013.
Misra NP, Gupta RC. A comparison of a short course of single daily dosage therapy of tinidazole with metronidazole in intestinal amoebiasis. J Int Med Res 1977; 5:434.
Singh G, Kumar S. Short course of single daily dosage treatment with tinidazole and metronidazole in intestinal amoebiasis: a comparative study. Curr Med Res Opin 1977; 5:157.
Mackey-Lawrence NM, Petri WA Jr. Amoebic dysentery. BMJ Clin Evid 2011; 2011.





