Patología Umbilical: Revisión de las Entidades más Frecuentes.

Debido a las múltiples patologías del cordón umbilical que se presentan en el neonato, es de suma importancia mantenerse al día y saberlas diagnosticar oportunamente. Daremos una breve revisión a la anatomía, seguido de una revisión de la patología umbilical más frecuente: hernia umbilical, gastrosquisis, persistencia del conducto onfalomesentérico, la onfalitis, granuloma umbilical, onfalocele y otras.
El cordón umbilical contiene dos arterias y una vena rodeados y sostenidos por un tejido gelatinoso llamado gelatina de Wharton. La vena lleva sangre oxigenada y nutrientes de la madre hacia el feto, mientras que las arterias llevan sangre desoxigenada del feto a la madre. Los vasos del cordón umbilical se cierran funcionalmente posterior al parto, pero persisten anatómicamente abiertos hasta las dos semanas de edad.
La vena se convierte en el ligamento redondo; el conducto venoso, en el ligamento venoso; y las arterias umbilicales, en los ligamentos umbilicales laterales. El cordón umbilical se cae antes de los 7 a 14 días de vida. El retraso en este proceso después del mes de edad es sugerente de inmunodeficiencias primarias o infección.
Diámetro y Longitud
Al nacer, el diámetro y la circunferencia promedio del cordón umbilical en un niño a término es de 1.5 y 3.6 cm, respectivamente. Tanto los cordones umbilicales gruesos como los delgados se asocian a un mayor riesgo de patología importante. El cordón umbilical se alarga durante la gestación desde una media de 32 cm a las 20 semanas de gestación hasta 60 cm a término. Dentro de cada grupo de edad gestacional, la longitud es muy variable. Como ejemplo, en recién nacidos a término nacidos entre las semanas 40 y 41 de gestación, la longitud umbilical varía de 35 a 80 cm.
Aunque la longitud del cordón umbilical no tiene ningún efecto sobre el flujo sanguíneo fetal, tanto los cordones largos como los cortos se asocian con efectos adversos sobre el bebé. Con cordones umbilicales más largos, existe un mayor riesgo de nudos del cordón, circular de cuello (cordón umbilical enrollado alrededor del cuello del feto en el momento del nacimiento), prolapso del cordón, trombos y muerte fetal. Los cordones umbilicales cortos (<35 cm) se han asociado con desprendimiento de la placenta y anomalías del desarrollo.
Los cordones cortos sin enrollamiento se asocian con un crecimiento fetal y una actividad disminuidos, lo que puede ocurrir en fetos con anormalidades neurales y musculoesqueléticas severas. Debido a que los vasos umbilicales son más largos que el cordón en sí, es común la torsión y doblez de los vasos dentro del cordón umbilical. Se piensa que el enrollamiento del cordón umbilical protege el suministro de sangre de la disrupción mecánica. Aunque se desconoce el mecanismo de enrollamiento, tanto el exceso como la disminución de este proceso se asocian con resultados perinatales adversos.
Malformaciones Umbilicales
Arteria Umbilical Única
La arteria umbilical única está presente en el 0.2 a 0.6% de los nacidos vivos, ocurriendo con mayor frecuencia en pequeños para edad gestacional, bebés prematuros y gemelos. En los bebés con arteria umbilical única, hay una mayor tasa de anomalías cromosómicas y otras anomalías congénitas. Múltiples estudios han demostrado que del 20 al 30% de los recién nacidos con arteria umbilical única tienen anomalías estructurales importantes, a menudo en múltiples órganos. Los órganos más comúnmente afectados son el corazón, el tracto gastrointestinal y el sistema nervioso central.
La arteria umbilical única es un hallazgo aislado en el 70 a 80% restante de los bebés. En estos neonatos, hay una mayor incidencia de anomalías renales ocultas. Esto fue ilustrado en un metanálisis de siete estudios que incluyeron 204 lactantes que fueron evaluados para detectar malformaciones renales, ya sea por ultrasonografía o pielografía intravenosa. Se detectó una anomalía renal en el 16% de estos bebés. Sin embargo, la anormalidad fue persistente y se consideró clínicamente significativa en solo la mitad (8%). El reflujo vesicoureteral grado 2 o superior fue el principal hallazgo renal y se encontró en el 3% de la población total del estudio.
Anomalías del Uraco
El uraco normalmente involuciona, dando como resultado un cordón fibroso entre el ombligo y la vejiga en el espacio preperitoneal. La interrupción de este proceso puede conducir a una variedad de alteraciones poco frecuentes. La permeabilidad completa da como resultado un uraco permeable con comunicación libre entre la vejiga y el ombligo. Estos niños pueden presentarse al nacer con un cordón umbilical gigante. Los niños mayores generalmente se presentan con un ombligo persistentemente húmedo o con drenaje, y ocasionalmente con una infección del tracto urinario.
El tejido persistente en el ombligo sin conexión con la vejiga da como resultado un pólipo umbilical. Mientras que el tejido persistente en la vejiga sin conexión con el ombligo produce un divertículo vesical. El divertículo vesical puede causar obstrucción ureteral en el sitio de inserción de la vejiga.
El conducto con permeabilidad central y cierre tanto en el ombligo como en la vejiga da como resultado un quiste del uraco. El quiste puede presentarse como una masa, especialmente en niños mayores y adultos. El quiste puede infectarse con flora cutánea grampositiva o enterobacterias gramnegativas y presentar signos o síntomas asociados de dolor abdominal, eritema o edema, generalmente localizados debajo del ombligo.
Persistencia del Conducto Onfalomesentérico
La falla parcial o completa de la involución del conducto onfalomesentérico puede conducir a una variedad de anomalías en el recién nacido debido a los diversos grados y la ubicación de la permeabilidad del conducto. La permeabilidad completa del conducto onfalomesentérico conecta directamente el ombligo con el íleon terminal. Esto puede conducir a la evacuación intestinal desde el ombligo. Con frecuencia, estos bebés tienen un “estoma” en el ombligo después de la separación del cordón.
Un conducto onfalomesentérico persistente en el ombligo sin conexión intestinal da como resultado un pólipo umbilical. El tejido persistente en el íleon, sin conexión con el ombligo da como resultado el divertículo de Meckel. La permeabilidad central y cierre tanto en el extremo umbilical como en el ileal del conducto onfalomesentérico da como resultado un quiste del conducto onfalomesentérico. Debido a que los dos extremos están fijos, esto puede conducir a la obstrucción del intestino delgado si el intestino se tuerce alrededor del quiste.
El cordón fibroso persistente entre el ombligo y el íleon terminal puede conducir a la obstrucción del intestino delgado. Como puede haber más de una anomalía del conducto onfalomesentérico, se debe realizar una evaluación radiológica en pacientes con una anomalía. Esto debe incluir una ecografía y posiblemente una evaluación del divertículo de Meckel (con tecnecio pertecnetato 99m, que tiene una afinidad por la mucosa gástrica). Si los resultados de la ecografía son inciertos, se realiza una tomografía computarizada.
Tratamiento
La escisión quirúrgica se realiza típicamente para el remanente del conducto onfalomesentérico. Sin embargo, el tratamiento para el divertículo de Meckel es controvertido. En adultos mayores asintomáticos, la decisión de resección depende de la edad del paciente, el tamaño y si existe una anomalía palpable, pero en niños, la resección quirúrgica se realiza tanto para el divertículo de Meckel sintomático como para cualquier hallazgo asintomático debido al riesgo de complicaciones y malignidad.
Granuloma Umbilical
En los recién nacidos, el granuloma umbilical es una anormalidad común y es la causa más común de una masa umbilical. Es una lesión blanda, húmeda, rosada, generalmente pedunculada y friable de tejido de granulación que varía en tamaño de 3 a 10 mm de longitud. El granuloma umbilical se forma en las primeras semanas de vida a partir del exceso de tejido que persiste en la base del ombligo después de la separación del cordón. La formación de granulomas es más probable que ocurra cuando hay inflamación del cordón umbilical generalmente debido a una infección, que también retrasa la separación del cordón.
El granuloma umbilical se detecta con mayor frecuencia después de que el cordón se ha separado debido al drenaje persistente del líquido seroso o serohemático, o la humedad alrededor del ombligo. El tratamiento más común para el granuloma umbilical es el nitrato de plata tópico al 75%, generalmente aplicado con un aplicador de madera con nitrato de plata premontado. La lesión se trata una o dos veces por semana durante varias semanas, pero generalmente solo se requieren unas pocas aplicaciones para un tratamiento exitoso. Se debe tener precaución al aplicar nitrato de plata porque puede causar quemaduras químicas o manchas en la piel circundante.
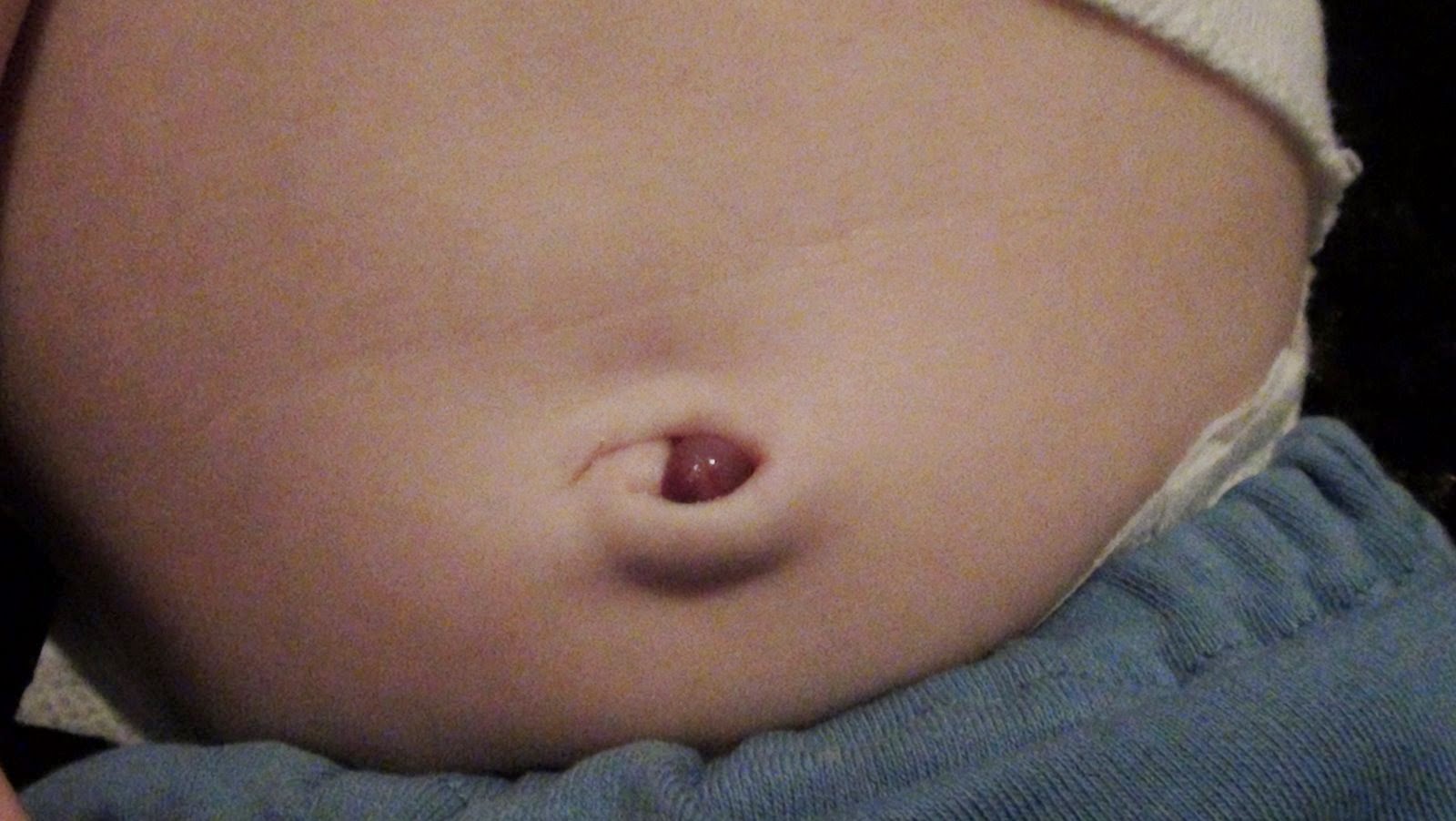
En los casos que no responden al nitrato de plata tópico, se puede realizar la ligadura en el consultorio sin molestias. Antes de la ligadura, el ombligo debe examinarse cuidadosamente para descartar otras causas de masas umbilicales, como el pólipo umbilical. La falla en el tratamiento del granuloma mediante ligadura y/o nitrato de plata es sugerente de que la lesión es en realidad un pólipo umbilical.
Pólipo Umbilical
Los pólipos umbilicales son masas firmes formadas por epitelio intestinal o uroepitelial, los cuales son restos embriológicos onfalomesentéricos o uraquiales. Los pólipos umbilicales son raros y, a menudo, más grandes que los granulomas, no responden al tratamiento con nitrato de plata y requieren de escisión quirúrgica. Si hay dudas sobre si una masa umbilical en un neonato es un pólipo o un granuloma, se debe realizar una evaluación histopatológica de la lesión. Si se diagnostica un pólipo, se debe realizar una evaluación adicional de las anomalías embriológicas asociadas (p.e. divertículo de Meckel).
Hernia Umbilical
La abertura umbilical de la fascia (anillo umbilical) existe para permitir el paso de los vasos umbilicales de la madre al feto. Después del nacimiento, esta abertura de la fascia se cierra espontáneamente con el crecimiento continuo de los músculos rectos del abdomen. Al final, el cierre completo se produce con la fusión de las capas peritoneal y de la fascia dentro de una pequeña área fibrosa del ombligo. El cierre del anillo umbilical se completa en casi todos los niños a los cinco años de edad.
El cierre espontáneo es menos probable que ocurra en pacientes que tienen una abertura de la fascia mayor de 1.5 cm, una cantidad importante de piel que sobresale, niños mayores o que tienen una afección predisponente subyacente. Las hernias umbilicales se observan con frecuencia en pacientes con Ehlers-Danlos, síndrome de Beckwith-Wiedemann, síndrome de Down, mucopolisacaridosis, hipotiroidismo o trisomía 18. El aumento de la presión intraabdominal por ascitis o diálisis peritoneal también puede prevenir el cierre del anillo umbilical, lo que resulta en una hernia.
Hallazgos clínicos
Aunque la gran mayoría de los pacientes pediátricos con hernias umbilicales son asintomáticos, en casos raros, la hernia puede interferir con la alimentación, especialmente en los bebés pequeños con hernias que contienen intestino. Las hernias umbilicales se detectan durante el examen abdominal del recién nacido, especialmente cuando hay un aumento de la presión intraabdominal por el llanto. Las hernias umbilicales se reducen fácilmente incluso si son bastante grandes, y los bordes de los defectos de la fascia se pueden palpar a través de la piel.
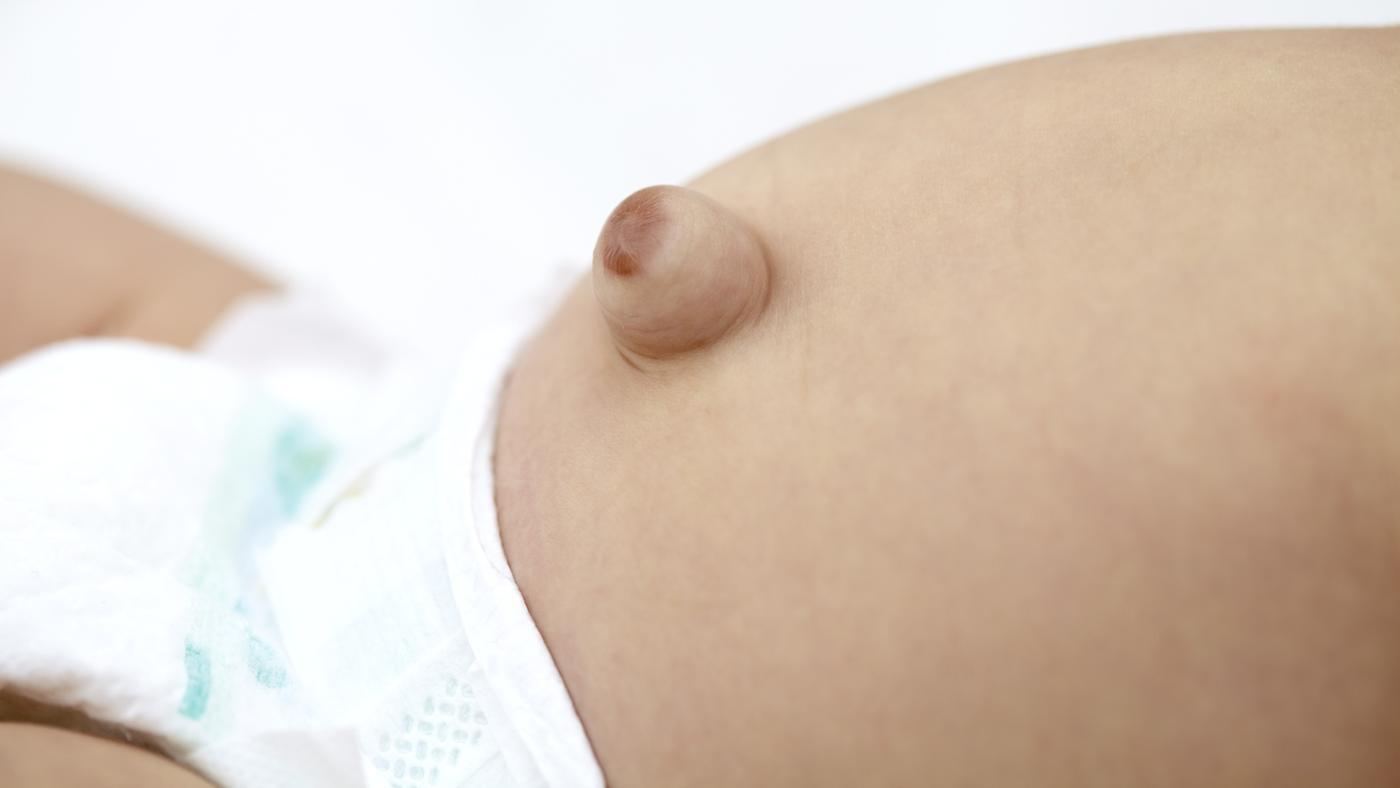
El defecto de la fascia predice con mayor precisión si ocurrirá un cierre espontáneo, no el grado de protrusión. Es importante diferenciar las hernias umbilicales de las hernias de la pared abdominal menos comunes (también llamadas ventrales o supraumbilicales) que no se cierran espontáneamente. En los niños, las hernias umbilicales rara vez se encarcelan (incapacidad para reducirlas por manipulación) o se estrangulan (compromiso vascular del contenido de una hernia encarcelada) o incluso más raramente se rompen.
Tratamiento de la Hernia Umbilical
Debido a que el curso natural del anillo umbilical es el cierre eventual, la mayoría de las hernias umbilicales se resolverán espontáneamente. En general, se pueden observar niños asintomáticos con un anillo umbilical que continúa disminuyendo. La intervención quirúrgica se requiere solo en una minoría de pacientes. La hernia umbilical encarcelada en niños es una indicación absoluta de reparación quirúrgica para evitar el estrangulamiento.
Los niños con hernias grandes, probóscide (tipo tronco), sin ninguna disminución en el tamaño del defecto del anillo umbilical durante los primeros dos años de vida, generalmente requieren cirugía, porque sus hernias no se cerrarán espontáneamente. Otras indicaciones relativas para la reparación quirúrgica incluyen defectos que dejan de disminuir en tamaño, son sintomáticos, crean problemas importantes de comportamiento o no se cierran en niños mayores de cinco años.
Aunque existe la costumbre popular de fajar la hernia umbilical para promover el cierre, esta práctica puede conducir a complicaciones de la piel tales como maceración e infección y no debe realizarse.
Onfalocele
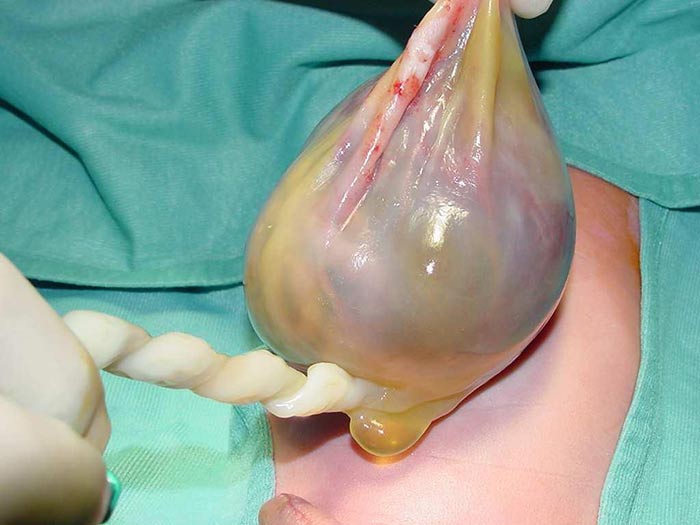
Un onfalocele es un defecto sobre la línea media de la pared abdominal de tamaño variable, cubierto por una membrana de amnios y peritoneo con gelatina de Wharton entre las dos capas, y de contenido abdominal. El defecto se produce en la base del cordón umbilical, y los cordones/vasos umbilicales se insertan en el vértice del saco de onfalocele.
Diagnóstico Postnatal
El diagnóstico postnatal de onfalocele se basa en el examen físico que muestra el hallazgo clínico característico de una masa abdominal de la línea media anterior con una membrana de cobertura en el sitio de inserción del cordón, aunque la membrana que cubre puede ser difícil de romper. La ascitis puede estar presente y las anomalías asociadas son comunes.
Diagnóstico Prenatal
Al final del primer trimestre (11 a 14 semanas), casi todos los onfaloceles se pueden detectar mediante ultrasonido obstétrico. El onfalocele aparece como un defecto de la pared abdominal de la línea media superior, media o inferior de tamaño variable, cubierto por una membrana externa de amnios y una membrana interna de peritoneo con gelatina de Wharton entre las dos capas y que contiene contenido abdominal. El defecto es más comúnmente medio en la base del cordón umbilical, con los cordones/vasos umbilicales insertándose en el ápice del saco de onfalocele. El saco por lo general contiene intestino y puede contener hígado, estómago o vejiga. La ascitis se puede ver en el saco o el abdomen.
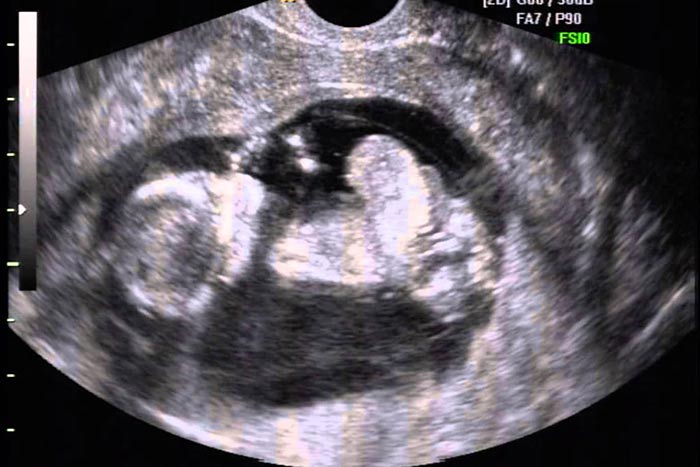
Clasificación
Los onfaloceles se clasifican según contengan hígado o no. El 80% de los onfaloceles contienen parte del hígado; el término onfalocele gigante se ha utilizado para describir los onfaloceles que contienen la mayoría (> 75%) del hígado o tienen un tamaño muy grande (absoluto o con respecto al feto), aunque “grande” se define de forma variable. La ubicación del hígado es importante, en parte porque los onfaloceles que no contienen hígado se asocian comúnmente con una aneuploidía fetal, mientras que los onfaloceles que contienen hígado generalmente se asocian con fetos euploides.
El diagnóstico prenatal de un onfalocele no hepático puede realizarse de manera confiable después de 12 semanas de gestación; antes de este tiempo puede ser difícil diferenciarlo de la herniación fisiológica de intestino medio. El diagnóstico prenatal de onfalocele que contiene hígado puede realizarse mediante ecografía transvaginal a las 9 o 10 semanas si se observa una imagen de una masa homogénea que mide más de 5 a 10 mm. de diámetro; ello sugiere hígado en el área de herniación fisiológica del intestino. El diagnóstico ecográfico de un onfalocele que contiene hígado se puede realizar antes de la 12 semana porque el hígado herniado nunca es un hallazgo normal del desarrollo.
El aumento de la translucidez nucal durante el primer trimestre para cribado del síndrome de Down se ha asociado a un mayor riesgo de anomalías estructurales fetales, incluido el onfalocele. La concentración sérica de alfa-fetoproteína sérica se encuentra elevada en la mayoría de los embarazos en los que se observa onfalocele en la ecografía del segundo trimestre.
Manejo Quirúrgico
La prioridad en la reparación de la pared abdominal es la preservación del flujo sanguíneo intestinal. En general, los defectos pequeños (de 2 a 3 cm) se pueden reparar en las primeras 24 a 72 horas de vida mediante el cierre primario de la fascia y la piel. El resto del espectro de defectos generalmente involucra algún tipo de silo en las primeras 24 horas de vida y un retraso en el cierre. El silo puede reducirse gradualmente durante tres a siete días en la unidad de cuidados intensivos, después de lo cual el bebé regresa al quirófano para el cierre definitivo de la pared abdominal.
La reducción de un defecto grande o uno que contiene un hígado anatómicamente retorcido se puede realizar con guía ecográfica Doppler para garantizar que la vena cava y el flujo hepático no se vean comprometidos durante la reducción del silo. Los onfaloceles gigantes (> 5 cm con> 75% de hígado) pueden tratarse con una combinación de silo, parche dérmico acelular e injerto de piel o promoviendo la formación de una costra del saco amniótico mediante la aplicación de una solución esclerosante (povidona yodada tópica), con reparación tardía de la hernia.
Después de la reducción del onfalocele, el neonato puede requerir ventilación mecánica prolongada debido a dificultad respiratoria y compresión de la cava. Los bebés con onfaloceles muy grandes que contienen la mayor parte del hígado pueden requerir múltiples procedimientos reconstructivos y tienen morbilidad a largo plazo. El estado nutricional, las anomalías asociadas y la hipoplasia pulmonar desempeñan un papel importante al determinar si el niño tendrá un buen resultado a largo plazo.
Gastrosquisis
La gastrosquisis es un defecto paraumbilical de la pared abdominal de grosor completo, generalmente asociado con la evisceración del intestino y en ocasiones de otros órganos abdominales. El hallazgo clínico característico en los recién nacidos es un defecto paraumbilical de la pared abdominal de grosor completo, a menudo asociado con la evisceración del intestino.
Por lo general, se encuentra a la derecha del sitio de inserción del cordón umbilical y tiende a ser <4 cm de diámetro. No lo recubre una membrana. La inflamación y la fibrosis por exposición crónica al líquido amniótico producen engrosamiento y enmarañado de los intestinos, disminución de la motilidad intestinal y posiblemente obstrucción luminal.
Manejo Quirúrgico
En el quirófano, el intestino se descomprime al aspirar el contenido del estómago y evacuar el intestino grueso a través del recto. El tamaño del defecto de la pared abdominal se agranda de 1 a 2 cm para minimizar el trauma al intestino durante la reducción. La pared abdominal se estira manualmente y se reemplaza el intestino, teniendo cuidado de evitar crear una presión intraabdominal demasiado alta. Aunque el cierre primario es exitoso en el 70% de los casos, si no tiene éxito, se puede usar un cierre por etapas con un silo de silastic como en los casos de onfalocele.
Si es poco probable que el cierre primario tenga éxito, se puede colocar un silo preformado con un anillo con resorte en la cabecera para cubrir el intestino herniado rápidamente sin suturar. La dismotilidad postoperatoria prolongada es un problema común e interfiere con la alimentación enteral. Los estudios en modelos animales sugieren que la dismotilidad se debe a un retraso en la maduración del sistema nervioso entérico, posiblemente como resultado de una exposición prolongada al líquido amniótico.
Onfalitis
La onfalitis es una infección del ombligo y/o los tejidos circundantes. Es predominantemente una enfermedad del neonato y se caracteriza por secreción purulenta del muñón del cordón umbilical con induración circundante, eritema y sensibilidad. El sangrado del muñón umbilical puede ocurrir en la onfalitis como resultado de la obliteración tardía de los vasos umbilicales. La onfalitis es rara en los países desarrollados, con una incidencia del 0.7%. Sin embargo, en los países en desarrollo, la incidencia estimada es de hasta el 8%.
Factores de Riesgo
En el recién nacido, los factores de riesgo para el desarrollo de onfalitis incluyen bajo peso al nacer, trabajo de parto prolongado, ruptura prematura de membranas o infección materna, parto no estéril, cateterismo umbilical y parto en el hogar. El cuidado inadecuado del cordón umbilical también aumenta el riesgo de onfalitis. Los trastornos del sistema inmunitario, como los defectos en la adhesión de los leucocitos, la función de los neutrófilos o los linfocitos natural killer y la producción de interferón, pueden contribuir al desarrollo de la onfalitis.
Afectación Sistémica y Complicaciones
Los signos sistémicos, que incluyen letargo, fiebre, irritabilidad y rechazo al alimento, sugieren una infección o complicación más grave. La complicación más común de la onfalitis es la sepsis. Otras complicaciones incluyen arteritis umbilical séptica, trombosis de la vena porta, absceso hepático, peritonitis, gangrena intestinal, evisceración del intestino delgado, fascitis necrotizante y muerte. Entre los bebés con onfalitis, la tasa de mortalidad se estima entre 7 y 15%. El sexo masculino, la prematurez, el parto séptico y la temperatura anormal son factores de riesgo reportados para un mal pronóstico en los lactantes con onfalitis. Aunque es raro, el desarrollo de fascitis necrotizante se asocia a una mayor tasa de mortalidad. Sin embargo, ésta entidad a menudo es difícil de diagnosticar sin exploración quirúrgica.
Diagnóstico Microbiológico
La onfalitis es una infección polimicrobiana. Históricamente, los patógenos predominantes incluían al Staphylococcus aureus, Streptococcus pyogenes y bacterias gramnegativas tales como Escherichia coli, Klebsiella pneumoniae y Proteus mirabilis. Sin embargo, con el uso rutinario de esquemas antiestafilocócicos, las infecciones por gramnegativas han aumentado.
Además, las bacterias anaerobias como Bacteroides fragilis, Clostridium perfringens y Clostridium tetani pueden contribuir a las infecciones umbilicales, especialmente en los bebés nacidos de madres con corioamnionitis. En estos bebés, el drenaje umbilical con mal olor es un hallazgo típico.
Siempre que sea posible, se deben obtener cultivos de la descarga antes del inicio de la terapia con antibióticos. También se debe obtener hemocultivo y cultivo del líquido cefalorraquídeo en niños con datos de afectación sistémica (p.e. fiebre) ya que es más probable que estén sépticos o desarrollen meningitis.
Tratamiento
El tratamiento antibiótico de la onfalitis es necesario y está dirigido contra organismos grampositivos y gramnegativos. En el neonato, se administran agentes antiestafilocócicos y aminoglucósidos administrados por vía parenteral para disminuir el riesgo de complicaciones importantes, como sepsis y fascitis necrotizante. En comunidades con una alta prevalencia de S. aureus resistente a la meticilina, se debe usar vancomicina en lugar de una penicilina antiestafilocócica.
La clindamicina o el metronidazol también se han sugerido en el tratamiento de lactantes con onfalitis para la cobertura anaeróbica, especialmente aquellos con secreción mal oliente o nacidos de madres con amnionitis. Por lo general, se indica un tratamiento por 10 días de antibióticos IV. en neonatos, que puede modificarse dependiendo de la respuesta clínica del paciente y si se desarrollan complicaciones. En pacientes mayores, se puede administrar una cobertura similar de antibióticos por vía oral, y se modifica en función de los resultados del cultivo y la mejoría clínica.
La descarga leve del muñón umbilical en ausencia de signos inflamatorios puede ser una ocurrencia normal, incluso cuando se acompaña de algún olor. Algunos médicos tratan a los bebés con síntomas mínimos con aplicaciones tópicas como alcohol, bacitracina o mupirocina. Sin embargo, no hay evidencia de la eficacia de esta práctica o de la eficacia de la administración de antibióticos orales en estos bebés. En los países en desarrollo, el cuidado tópico antiséptico del muñón umbilical reduce el riesgo de onfalitis y la mortalidad neonatal.
Referencias Bibliográficas
Moinian M, Meyer WW, Lind J. Diameters of umbilical cord vessels and the weight of the cord in relation to clamping time. Am J Obstet Gynecol 1969; 105:604.
Patel D, Dawson M, Kalyanam P, et al. Umbilical cord circumference at birth. Am J Dis Child 1989; 143:638.
Naeye RL. Umbilical cord length: clinical significance. J Pediatr 1985; 107:278.
Ananth CV, Oyelese Y, Yeo L, et al. Placental abruption in the United States, 1979 through 2001: temporal trends and potential determinants. Am J Obstet Gynecol 2005; 192:191.
Gilbert-Barness E, Drut RM, Drut R, et al. Developmental abnormalities resulting in short umbilical cord. Birth Defects Orig Artic Ser 1993; 29:113.
de Laat MW, Franx A, Bots ML, et al. Umbilical coiling index in normal and complicated pregnancies. Obstet Gynecol 2006; 107:1049.
Cullen T. Embryology, Anatomy, and Diseases of the Umbilicus Together with Diseases of the Urachus, WB Saunders, Philadephia 1916.
Coetzee T. Clinical anatomy of the umbilicus. S Afr Med J 1980; 57:463.
Friedman JM. Umbilical dysmorphology. The importance of contemplating the belly button. Clin Genet 1985; 28:343.
Wildhaber BE, Antonelli E, Pfister RE. The giant umbilical cord. Arch Dis Child Fetal Neonatal Ed 2005; 90:F535.
Iwasaki I, Yu TJ, Itahashi K, et al. Isolated well-formed intestinal tissue in the umbilical cord. A variant of cyst of omphalomesenteric duct. Acta Pathol Jpn 1986; 36:565.
Ameh EA, Nmadu PT. Major complications of omphalitis in neonates and infants. Pediatr Surg Int 2002; 18:413.
Ueno T, Hashimoto H, Yokoyama H, et al. Urachal anomalies: ultrasonography and management. J Pediatr Surg 2003; 38:1203.
Bourke WG, Clarke TA, Mathews TG, et al. Isolated single umbilical artery–the case for routine renal screening. Arch Dis Child 1993; 68:600.
Gornall AS, Kurinczuk JJ, Konje JC. Antenatal detection of a single umbilical artery: does it matter? Prenat Diagn 2003; 23:117.
Thummala MR, Raju TN, Langenberg P. Isolated single umbilical artery anomaly and the risk for congenital malformations: a meta-analysis. J Pediatr Surg 1998; 33:580.
Chow JS, Benson CB, Doubilet PM. Frequency and nature of structural anomalies in fetuses with single umbilical arteries. J Ultrasound Med 1998; 17:765.
Deshpande SA, Jog S, Watson H, Gornall A. Do babies with isolated single umbilical artery need routine postnatal renal ultrasonography? Arch Dis Child Fetal Neonatal Ed 2009; 94:F265.
de Boom ML, Kist-van Holthe JE, Sramek A, et al. Is screening for renal anomalies warranted in neonates with isolated single umbilical artery? Neonatology 2010; 97:225.
Stewart D, Benitz W. Umbilical Cord Care in the Newborn Infant. Pediatrics 2016; 138.
World Health Organization. WHO Recommendations on Postnatal Care of the Mother and Newborn. WHO Press; Geneva, 2014.
Sinha A, Sazawal S, Pradhan A, et al. Chlorhexidine skin or cord care for prevention of mortality and infections in neonates. Cochrane Database Syst Rev 2015; :CD007835.
Imdad A, Bautista RM, Senen KA, et al. Umbilical cord antiseptics for preventing sepsis and death among newborns. Cochrane Database Syst Rev 2013; :CD008635.
Gras-Le Guen C, Caille A, Launay E, et al. Dry Care Versus Antiseptics for Umbilical Cord Care: A Cluster Randomized Trial. Pediatrics 2017; 139.
Centers for Disease Control and Prevention (CDC). Neonatal tetanus–Montana, 1998. MMWR Morb Mortal Wkly Rep 1998; 47:928.
Mullany LC, Darmstadt GL, Khatry SK, et al. Impact of umbilical cord cleansing with 4.0% chlorhexidine on time to cord separation among newborns in southern Nepal: a cluster-randomized, community-based trial. Pediatrics 2006; 118:1864.
Mullany LC, Shah R, El Arifeen S, et al. Chlorhexidine cleansing of the umbilical cord and separation time: a cluster-randomized trial. Pediatrics 2013; 131:708.
Pezzati M, Biagioli EC, Martelli E, et al. Umbilical cord care: the effect of eight different cord-care regimens on cord separation time and other outcomes. Biol Neonate 2002; 81:38.
Wilson CB, Ochs HD, Almquist J, et al. When is umbilical cord separation delayed? J Pediatr 1985; 107:292.
Razvi S, Murphy R, Shlasko E, Cunningham-Rundles C. Delayed separation of the umbilical cord attributable to urachal anomalies. Pediatrics 2001; 108:493.
Vane DW, West KW, Grosfeld JL. Vitelline duct anomalies. Experience with 217 childhood cases. Arch Surg 1987; 122:542.
Crankson SJ, Ahmed GS, Palkar V. Patent omphalomesenteric duct of the vermiform appendix in a neonate: congenital appendicoumbilical fistula. Pediatr Surg Int 1998; 14:229.
Thirunavukarasu P, Sathaiah M, Sukumar S, et al. Meckel’s diverticulum–a high-risk region for malignancy in the ileum. Insights from a population-based epidemiological study and implications in surgical management. Ann Surg 2011; 253:223.
Gleason JM, Bowlin PR, Bagli DJ, et al. A comprehensive review of pediatric urachal anomalies and predictive analysis for adult urachal adenocarcinoma. J Urol 2015; 193:632.
Naiditch JA, Radhakrishnan J, Chin AC. Current diagnosis and management of urachal remnants. J Pediatr Surg 2013; 48:2148.
Ashley RA, Inman BA, Routh JC, et al. Urachal anomalies: a longitudinal study of urachal remnants in children and adults. J Urol 2007; 178:1615.
Widni EE, Höllwarth ME, Haxhija EQ. The impact of preoperative ultrasound on correct diagnosis of urachal remnants in children. J Pediatr Surg 2010; 45:1433.
Walker SH. The natural history of umbilical hernia. A six-year follow up of 314 Negro children with this defect. Clin Pediatr (Phila) 1967; 6:29.
Hall DE, Roberts KB, Charney E. Umbilical hernia: what happens after age 5 years? J Pediatr 1981; 98:415.
Meier DE, OlaOlorun DA, Omodele RA, et al. Incidence of umbilical hernia in African children: redefinition of “normal” and reevaluation of indications for repair. World J Surg 2001; 25:645.
Cilley R. Disorders of the umbilicus. In: Pediatric Surgery, Grosfeld J, O’Neill J, Coran A, Fonkalsrud E (Eds), Mosby Inc., Philadelphia 2006.
Katz DA. Evaluation and management of inguinal and umbilical hernias. Pediatr Ann 2001; 30:729.
Colige A, Sieron AL, Li SW, et al. Human Ehlers-Danlos syndrome type VII C and bovine dermatosparaxis are caused by mutations in the procollagen I N-proteinase gene. Am J Hum Genet 1999; 65:308.
Young ID, Harper PS. The natural history of the severe form of Hunter’s syndrome: a study based on 52 cases. Dev Med Child Neurol 1983; 25:481.
LaFranchi SH, Murphey WH, Foley TP Jr, et al. Neonatal hypothyroidism detected by the Northwest Regional Screening Program. Pediatrics 1979; 63:180.
Tank ES, Hatch DA. Hernias complicating chronic ambulatory peritoneal dialysis in children. J Pediatr Surg 1986; 21:41.
Blumberg NA. Infantile umbilical hernia. Surg Gynecol Obstet 1980; 150:187.
Papagrigoriadis S, Browse DJ, Howard ER. Incarceration of umbilical hernias in children: a rare but important complication. Pediatr Surg Int 1998; 14:231.
Okada T, Yoshida H, Iwai J, et al. Strangulated umbilical hernia in a child: report of a case. Surg Today 2001; 31:546.
Zens T, Nichol PF, Cartmill R, Kohler JE. Management of asymptomatic pediatric umbilical hernias: a systematic review. J Pediatr Surg 2017; 52:1723.
Brandt ML. Pediatric hernias. Surg Clin North Am 2008; 88:27.
Pomeranz A. Anomalies, abnormalities, and care of the umbilicus. Pediatr Clin North Am 2004; 51:819.
Brødsgaard A, Nielsen T, Mølgaard U, et al. Treating infants for umbilical granuloma with topical clobetasol propionate cream. Acta Paediatr 2015; 104:e49.
Aydin M, Orman A, Deveci U, Taskin E. Topical clobetasol propionate may not be safe for treating umbilical granuloma in infants. Acta Paediatr 2015; 104:e49.
Sheth SS, Malpani A. The management of umbilical granulomas with cryocautery. Am J Dis Child 1990; 144:146.
Larralde de Luna M, Cicioni V, Herrera A, et al. Umbilical polyps. Pediatr Dermatol 1987; 4:341.
Oğuzkurt P, Kotiloğlu E, Tanyel FC, Hiçsönmez A. Umbilical polyp originating from urachal remnants. Turk J Pediatr 1996; 38:371.
Avolio L, Cerritello A, Verga L. Heterotopic pancreatic tissue at umbilicus. Eur J Pediatr Surg 1998; 8:373.
Ito F, Ando H, Watanabe Y, et al. An accessory lobe of the liver disturbing closure of the umbilical ring. Pediatr Surg Int 1999; 15:394.
Skinner MA, Grosfeld JL. Inguinal and umbilical hernia repair in infants and children. Surg Clin North Am 1993; 73:439.
Veloso FT, Cardoso V, Fraga J, et al. Spontaneous umbilical fistula in Crohn’s disease. J Clin Gastroenterol 1989; 11:197.
Cushing AH. Omphalitis: a review. Pediatr Infect Dis 1985; 4:282.
Rotimi VO, Duerden BI. The development of the bacterial flora in normal neonates. J Med Microbiol 1981; 14:51.
Harnden A, Lennon D. Serious suppurative group A streptococcal infections in previously well children. Pediatr Infect Dis J 1988; 7:714.
McKenna H, Johnson D. Bacteria in neonatal omphalitis. Pathology 1977; 9:111.
Sawardekar KP. Changing spectrum of neonatal omphalitis. Pediatr Infect Dis J 2004; 23:22.
Mir F, Tikmani SS, Shakoor S, et al. Incidence and etiology of omphalitis in Pakistan: a community-based cohort study. J Infect Dev Ctries 2011; 5:828.
Davies EG, Isaacs D, Levinsky RJ. Defective immune interferon production and natural killer activity associated with poor neutrophil mobility and delayed umbilical cord separation. Clin Exp Immunol 1982; 50:454.
Mason WH, Andrews R, Ross LA, Wright HT Jr. Omphalitis in the newborn infant. Pediatr Infect Dis J 1989; 8:521.
Hayward AR, Harvey BA, Leonard J, et al. Delayed separation of the umbilical cord, widespread infections, and defective neutrophil mobility. Lancet 1979; 1:1099.
Güvenç H, Aygün AD, Yaşar F, et al. Omphalitis in term and preterm appropriate for gestational age and small for gestational age infants. J Trop Pediatr 1997; 43:368.
Chamberlain JW. Omphalitis in the newborn. J Pediatr 1936; 9:215.
Brook I. Bacteriology of neonatal omphalitis. J Infect 1982; 5:127.
Faridi MM, Rattan A, Ahmad SH. Omphalitis neonatorum. J Indian Med Assoc 1993; 91:283.
Brook I. Cutaneous and subcutaneous infections in newborns due to anaerobic bacteria. J Perinat Med 2002; 30:197.
Hsieh WS, Yang PH, Chao HC, Lai JY. Neonatal necrotizing fasciitis: a report of three cases and review of the literature. Pediatrics 1999; 103:e53.
Duhamel B. Embryology of Exomphalos and Allied Malformations. Arch Dis Child 1963; 38:142.
HUTCHIN P. SOMATIC ANOMALIES OF THE UMBILICUS AND ANTERIOR ABDOMINAL WALL. Surg Gynecol Obstet 1965; 120:1075.
Cyr DR, Mack LA, Schoenecker SA, et al. Bowel migration in the normal fetus: US detection. Radiology 1986; 161:119.
Margulis L. Omphalocele (amnicele). Am J Obstet Gynecol 1945; 49:695.
Corey KM, Hornik CP, Laughon MM, et al. Frequency of anomalies and hospital outcomes in infants with gastroschisis and omphalocele. Early Hum Dev 2014; 90:421.
Mayer T, Black R, Matlak ME, Johnson DG. Gastroschisis and omphalocele. An eight-year review. Ann Surg 1980; 192:783.
Henrich K, Huemmer HP, Reingruber B, Weber PG. Gastroschisis and omphalocele: treatments and long-term outcomes. Pediatr Surg Int 2008; 24:167.
Ardinger HH, Williamson RA, Grant S. Association of neural tube defects with omphalocele in chromosomally normal fetuses. Am J Med Genet 1987; 27:135.
Segel SY, Marder SJ, Parry S, Macones GA. Fetal abdominal wall defects and mode of delivery: a systematic review. Obstet Gynecol 2001; 98:867.
Biard JM, Wilson RD, Johnson MP, et al. Prenatally diagnosed giant omphaloceles: short- and long-term outcomes. Prenat Diagn 2004; 24:434.
Townsend. Abdomen. In: Sabiston Textbook of Surgery, 16th ed, WB Saunders Co, Philadelphia 2001. p.1478.
Pacilli M, Spitz L, Kiely EM, et al. Staged repair of giant omphalocele in the neonatal period. J Pediatr Surg 2005; 40:785.
Poznanski AK. Fetal omphalocele: prenatal US detection of concurrent anomalies and other predictors of outcome. Radiology 1990; 177:883.
Friedman AM, Ananth CV, Siddiq Z, et al. Gastroschisis: epidemiology and mode of delivery, 2005-2013. Am J Obstet Gynecol 2016; 215:348.e1.
Corey KM, Hornik CP, Laughon MM, et al. Frequency of anomalies and hospital outcomes in infants with gastroschisis and omphalocele. Early Hum Dev 2014; 90:421.
Carpenter MW, Curci MR, Dibbins AW, Haddow JE. Perinatal management of ventral wall defects. Obstet Gynecol 1984; 64:646.
Santiago-Munoz PC, McIntire DD, Barber RG, et al. Outcomes of pregnancies with fetal gastroschisis. Obstet Gynecol 2007; 110:663.
Netta DA, Wilson RD, Visintainer P, et al. Gastroschisis: growth patterns and a proposed prenatal surveillance protocol. Fetal Diagn Ther 2007; 22:352.
Yazdy MM, Mitchell AA, Werler MM. Maternal genitourinary infections and the risk of gastroschisis. Am J Epidemiol 2014; 180:518.
Tan KH, Kilby MD, Whittle MJ, et al. Congenital anterior abdominal wall defects in England and Wales 1987-93: retrospective analysis of OPCS data. BMJ 1996; 313:903.
Mastroiacovo P, Lisi A, Castilla EE, et al. Gastroschisis and associated defects: an international study. Am J Med Genet A 2007; 143A:660.
Morrow RJ, Whittle MJ, McNay MB, et al. Prenatal diagnosis and management of anterior abdominal wall defects in the west of Scotland. Prenat Diagn 1993; 13:111.
Saller DN Jr, Canick JA, Palomaki GE, et al. Second-trimester maternal serum alpha-fetoprotein, unconjugated estriol, and hCG levels in pregnancies with ventral wall defects. Obstet Gynecol 1994; 84:852.
Hunter A, Soothill P. Gastroschisis–an overview. Prenat Diagn 2002; 22:869.
Wilson RD, Johnson MP. Congenital abdominal wall defects: an update. Fetal Diagn Ther 2004; 19:385.
Prefumo F, Izzi C. Fetal abdominal wall defects. Best Pract Res Clin Obstet Gynaecol 2014; 28:391.
Townsend CM. Abdomen. In: Sabiston Textbook of Surgery, WB Saunders Co, Philadelphia 2001. p.1478.
Bianchi DW, Crombleholme TM, D’Alton ME. Omphalocele. In: Fetology, McGraw-Hill, New York 2000. p.483.
Olesevich M, Alexander F, Khan M, Cotman K. Gastroschisis revisited: role of intraoperative measurement of abdominal pressure. J Pediatr Surg 2005; 40:789.
Pastor AC, Phillips JD, Fenton SJ, et al. Routine use of a SILASTIC spring-loaded silo for infants with gastroschisis: a multicenter randomized controlled trial. J Pediatr Surg 2008; 43:1807.