Difteria: Claves de una Infección (ya no tan) Rara y Mortal.

La difteria es causada por el bacilo grampositivo Corynebacterium diphtheriae. La infección puede provocar enfermedad respiratoria, cutánea o un estado de portador asintomático. El nombre difteria proviene de la palabra griega cuero, que se refiere a la pseudomembrana faríngea resistente y que es el signo clínico distintivo de esta infección. A continuación hacemos una revisión con las claves de este padecimiento (ya no tan) raro pero mortal.
A pesar de que la difteria se sigue considerando una enfermedad rara, es importante conocerla y saberla diagnosticar debido al resurgimiento de múltiples padecimientos infecciosos y al movimiento antivacunas. Existen al menos cuatro biotipos de Corynebacterium diphtheriae: gravis, intermedius, mitis y belfanti. Todos ellos se han asociado con difteria tanto endémica como epidémica, aunque, en general, las cepas de mitis son menos toxigénicas y causan enfermedades menos graves. Las principales vías de contagio consisten en un contacto estrecho con material infeccioso de las secreciones respiratorias (directo o a través de gotas en el aire) o de lesiones cutáneas.
Se cree que los seres humanos son el único reservorio conocido de C. diphtheriae, aunque se ha observado la transmisión de C. ulcerans a través de la leche de vaca. La infección puede ocurrir a lo largo del año con una incidencia máxima en los meses más fríos. Los portadores asintomáticos son importantes para la transmisión de la difteria. La inmunidad (ya sea por infección natural o inducida por la vacuna) no previene el estado de portador. En áreas endémicas, hasta 5% de las personas sanas pueden tener cultivos faríngeos positivos para C. diphtheriae. Durante los años 1930 y 1940, la difteria prácticamente se eliminó en muchos países desarrollados después de la introducción de la vacunación infantil con toxoide diftérico.
Como resultado de ello, las cepas toxigénicas de C. diphtheriae perdieron su ventaja selectiva conferida por el gen tox+ y son menos prevalentes. A medida que la población general se ha vuelto inmune, hay menos casos de difteria clínica (de cepas toxigénicas) y una colonización menos asintomática con cepas toxigénicas y, por tanto, una menor transmisión a personas no inmunes. Sin embargo, no parece haber ninguna reducción en la prevalencia de portadores de C. diphtheriae no toxigénica. Las personas inmunizadas pueden desarrollar difteria clínica, aunque la enfermedad es menos grave y ocurre con menor frecuencia. La difteria está reapareciendo en algunas regiones.
En los países que experimentan un resurgimiento de la difteria, las epidemias han involucrado a niños y adultos insuficientemente o no inmunizados. A pesar de la inmunidad incompleta, la tasa de enfermedad clínica es baja porque la inmunización global ha minimizado la transmisión de cepas toxigénicas. Si las cepas toxigénicas se diseminan de nuevo, la incidencia podría volver a aumentar.
Estatus de la Difteria en América Latina y España
Una alta tasa de inmunización ha convertido a la difteria en una enfermedad rara; durante los últimos 30 años, la incidencia mundial ha disminuido de aproximadamente 100,000 por año a menos de 8000 por año. En todo el mundo la tasa de vacunación es mayor al 80%. España tiene una tasa de inmunización alta; se informó sobre su primer caso de difteria desde 1986 en mayo de 2015 en un niño de seis años no vacunado; el paciente murió pero ocho contactos cercanos con la colonización se aislaron y fueron tratados con éxito. La vacunación previa probablemente protegió a dichos contactos de la enfermedad clínica.
La difteria sigue siendo una enfermedad grave en gran parte del mundo. Las áreas de endemicidad en América Latina incluyen Brasil, Colombia, República Dominicana, Ecuador, Haití y Paraguay. Los contactos cercanos de viajeros no vacunados o vacunados inadecuadamente en áreas endémicas también están en riesgo de infección.
Fisiopatología de la Difteria
La infección diftérica sintomática es el resultado de la inflamación localizada del tracto respiratorio o de la piel, así como los efectos locales y sistémicos de una potente exotoxina diftérica. La producción de exotoxinas depende de la presencia de un bacteriófago lisogénico que porta el gen que codifica la toxina (tox+). La toxina tiene un total de tres dominios. Un dominio está presente en el fragmento A (la unidad catalítica), y los dos dominios restantes están en el fragmento B: uno para la unión al receptor y otro que puede participar en la inserción y translocación de la membrana.
La toxina diftérica actúa intracelular, donde causa la muerte celular inactivando el factor de elongación 2. La toxina se une a un receptor de membrana que proporciona un mecanismo de entrada a las células. La toxina diftérica aprovecha un precursor del factor de crecimiento como receptor: el receptor de la toxina diftérica parece ser idéntico al precursor de un factor de crecimiento similar al factor de crecimiento epidérmico que se une a la heparina.
Clínica del Paciente con Difteria
La difteria respiratoria es típicamente causada por cepas productoras de toxina de C. diphtheriae; raramente, es causada por cepas toxigénicas de otras especies de Corynebacterium (C. ulcerans, C. hemolyticum o C. pseudotuberculosis). Los síntomas generalmente comienzan de dos a cinco días después de la infección. Además de los síntomas respiratorios, la absorción y diseminación de la toxina diftérica puede causar daño cardíaco (miocarditis), neurológico y renal. El inicio de los síntomas es gradual; siendo los síntomas de presentación más comunes dolor de garganta, malestar general, linfadenopatía cervical y fiebre baja. El primer hallazgo faríngeo es el eritema leve, que puede progresar a manchas aisladas de exudado gris y blanco.
En al menos un tercio de los casos, la elaboración local de toxina induce la formación de una pseudomembrana coalescente compuesta de fibrina necrótica, leucocitos, eritrocitos, células epiteliales y bacterias. Esta membrana se adhiere firmemente al tejido subyacente y sangra con el raspado. Además, puede extenderse a cualquier parte del tracto respiratorio, desde las narinas hasta el árbol traqueobronquial. Hasta dos tercios de los casos son faringoamigdalinos; la afectación de la laringe, nariz y traqueobronquial es menos común. La toxicidad sistémica aumenta a medida que la pseudomembrana se extiende.

En pacientes no tratados, el período infeccioso comienza al inicio de los síntomas y dura dos semanas en la mayoría; en algunos casos, puede durar hasta seis semanas. En pacientes tratados con antibióticos adecuados, el período infeccioso generalmente dura menos de cuatro días. Otros síntomas del tracto respiratorio varían según la localización:
- Los pacientes con difteria nasal por lo general experimentan una enfermedad leve y presentan secreción nasal serosa/purulenta, que puede causar irritación leve de las fosas nasales externas y del labio superior.
- La difteria laríngea a menudo se presenta con ronquera y tos. La laringe puede ser el único sitio de infección (la laringoscopia demostrará una pseudomembrana laríngea) o puede ser parte de un continuo de afectación del tracto respiratorio.
- La infección traqueobronquial generalmente se desarrolla secundaria a la propagación de la membrana y puede provocar compromiso respiratorio, especialmente en niños debido a vías respiratorias pequeñas.
Difteria maligna y el “cuello de toro”
Una forma de difteria maligna se asocia con una extensa faringitis membranosa, acompañada de edema masivo de las amígdalas, la úvula, los ganglios linfáticos cervicales, la región submandibular y la parte anterior del cuello, ocasionando el famoso “cuello de toro” de la difteria toxigénica. En tales casos, puede producirse un estridor respiratorio, que conduce a insuficiencia respiratoria y muerte. Además, la aspiración de la membrana puede conducir a la asfixia.

Afectación sistémica
La absorción y diseminación de la toxina diftérica puede causar miocarditis y afectar al sistema nervioso y riñones. El riesgo de desarrollar toxicidad cardíaca y/o neurológica es proporcional a la gravedad de la infección local. La falla renal aguda por acción directa de la toxina o hipotensión puede ocurrir en casos graves. Las cepas no toxigénicas de C. diphtheriae se han visto implicadas en casos de endocarditis, aneurismas micóticos, osteomielitis y artritis séptica.
Toxicidad Cardíaca
La miocarditis (sugerente por cambios electrocardiográficos, como alteraciones del ST-T, la prolongación del QT y/o bloqueo cardíaco de primer grado) puede presentarse en hasta 2/3 de los casos. Comienza generalmente cuando los síntomas respiratorios locales están mejorando. La disfunción cardíaca clínicamente evidente (disminución de los ruidos cardíacos, ritmo de galope, dilatación cardíaca, disnea) ocurre en 10 a 25% de los pacientes con difteria.
La miocarditis severa se manifiesta por bloqueos cardíacos, arritmias, insuficiencia cardíaca y colapso circulatorio. Los pacientes deben monitorearse con electrocardiogramas seriados y mediciones de enzimas cardíacas que reflejen la intensidad del daño miocárdico. Las complicaciones cardíacas son una causa importante de mortalidad. El lapso de tiempo para la aparición de la miocarditis es variable; generalmente ocurre de 7 a 14 días después del inicio de los síntomas respiratorios.
Toxicidad Neurológica
La toxicidad neurológica ocurre en aproximadamente el 5% de los pacientes. La toxicidad neurológica es inusual en pacientes con enfermedad leve, pero puede desarrollarse en hasta 75% de los pacientes con difteria grave. La neuropatía local (parálisis del paladar blando y la pared posterior de la faringe) es seguida de neuropatía craneal (generalmente oculomotora y ciliar, seguida de parálisis facial o laríngea). La neuritis periférica se desarrolla semanas o meses después y puede abarcar desde paresia leve a parálisis total. La gravedad de la enfermedad se correlaciona con la gravedad de la formación de la membrana (y la producción de toxinas), así como el tiempo transcurrido entre el inicio de los síntomas y la administración de antitoxina.
Difteria Cutánea
La difteria cutánea puede ser causada por cepas toxigénicas y no toxigénicas de C. diphtheriae, aunque la toxicidad sistémica es rara. La difteria cutánea se caracteriza por úlceras crónicas que no cicatrizan o úlceras superficiales con una membrana gris sucia; la apariencia es bastante inespecífica. La difteria cutánea también puede presentarse en forma de colonización e infección de dermatosis preexistentes. El diagnóstico se realiza cultivando el organismo a partir de una lesión cutánea.
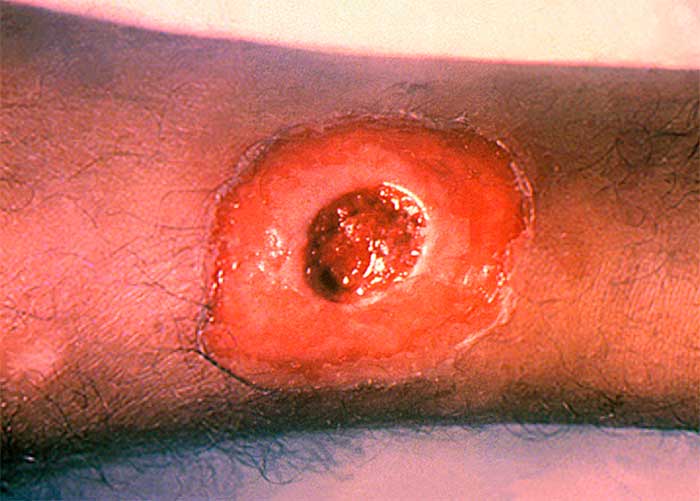
El trauma local frecuentemente precede a la infección cutánea. Se han producido brotes de enfermedad cutánea en poblaciones empobrecidas con escaso acceso al sistema de salud, como personas en situación de calle y usuarios de drogas IV. Las infecciones de la piel suelen dar lugar a una respuesta de anticuerpos enérgica, en contraste con las infecciones faríngeas (que pueden no dar lugar a la inmunidad posterior). Por tanto, los pacientes con infección de la piel tienen una probabilidad relativamente baja de desarrollar la variante faríngea de la enfermedad; sin embargo, las úlceras cutáneas sirven como reservorio para infectar huéspedes susceptibles, particularmente en regiones donde la inmunidad colectiva es baja debido a una vacunación subóptima.
Diagnóstico de Difteria
El diagnóstico de difteria debe considerarse en el contexto de manifestaciones clínicas relevantes (dolor de garganta, malestar, linfadenopatía cervical, y fiebre baja) junto con los factores de riesgo epidemiológicos antes mencionados. El eritema faríngeo leve típicamente progresa a áreas de exudado blanco; estas se unen para formar una pseudomembrana gris adherente que sangra al raspado. La sospecha clínica de difteria debe establecerse ante el hallazgo de membranas adherentes faríngeas, palatinas o nasales, toxicidad sistémica, ronquera, estridor, parálisis palatina y/o la secreción nasal serosa.
El diagnóstico definitivo de difteria requiere cultivo de C. diphtheriae de secreciones del tracto respiratorio o lesiones cutáneas y detección de toxina positiva. Los exámenes de laboratorio de rutina generalmente no son específicos y pueden revelar únicamente un recuento leucocitario moderadamente elevado y proteinuria.
Cultivo y tinciones
Debe solicitarse cultivo de muestras obtenidas de la garganta y la nariz, incluida una porción de la membrana (si es posible) y material de debajo de ella. Se requieren medios de cultivo especiales (Loffler o Tindale); el laboratorio de microbiología debe ser notificado del diagnóstico probable para que la muestra se coloque en los medios apropiados. El transporte al laboratorio debe realizarse rápidamente ya que los medios deben inocularse rápidamente. Se puede realizar un diagnóstico presuntivo de C. diphtheriae identificando bacterias gram positivas en una distribución de “caracteres chinos” en tinción de Gram o colonias negras con halos en los medios de Tindale, así como gránulos metacromáticos en los medios de Loffler.
Una vez que el organismo es presuntivamente identificado, se pueden realizar pruebas bioquímicas para confirmarlo. C. diphtheriae es catalasa positiva, ureasa negativa, cistinasa positiva y pirazinamidasa negativa. Se debe realizar determinación de la producción de toxinas para diferenciar las cepas toxigénicas de las no toxigénicas de C. diphtheriae. Si la sospecha clínica de difteria es alta, la antitoxina debe administrarse rápidamente antes de confirmar la producción de toxinas, dado que ello puede demorar varios días según el método utilizado.
La producción de toxinas puede demostrarse mediante una prueba in vitro que detecta el desarrollo de una banda de inmunoprecipitina sobre papel de filtro impregnado de antitoxina y colocado sobre un cultivo de agar del organismo (prueba de Elek). La prueba requiere un control de calidad de los reactivos y un procedimiento estandarizado, por lo que se realiza mejor en un laboratorio de referencia.
PCR y EIA
Se pueden realizar pruebas de PCR para la subunidad A del gen de la toxina diftérica. Una PCR positiva para el gen de la toxina diftérica demuestra la presencia del gen pero no indica si se está produciendo la toxina; por tanto, los resultados positivos de PCR deben confirmarse por cultivo para establecer la presencia de enfermedad clínica debido a una cepa toxigénica de C. diphtheriae. Una PCR negativa es útil para excluir el diagnóstico de difteria. La PCR se puede realizar en colonias extraídas de una placa o en muestras clínicas.
Se ha desarrollado un inmunoensayo enzimático rápido para la detección de la producción de toxina diftérica. En un estudio de 245 cepas mixtas de Corynebacterium, se observaron resultados comparables con EIA y Elek, aunque la prueba de EIA fue mucho más rápida (3 versus 24 horas).
Diagnóstico Diferencial
El diagnóstico diferencial de la difteria respiratoria incluye:
- Mononucleosis infecciosa: las manifestaciones clínicas de la mononucleosis infecciosa incluyen fiebre, faringitis, adenopatía y fatiga. Los hallazgos de laboratorio incluyen linfocitosis atípica; el diagnóstico se establece en función de la presencia de anticuerpos heterófilos.
- Faringoamigdalitis estreptocócica del grupo A: las manifestaciones clínicas de la faringitis estreptocócica incluyen la presencia de exudados amigdalinos, adenopatía cervical anterior dolorosa, antecedentes de fiebre y ausencia de tos. El diagnóstico se establece mediante una prueba o cultivo rápido de detección de antígeno.
- Epiglotitis: las manifestaciones clínicas de la epiglotitis incluyen fiebre, dolor de garganta, disfagia, babeo y y dificultad respiratoria. El diagnóstico se realiza mediante la visualización de la epiglotis o la demostración de edema epiglottal en la radiografía lateral del cuello.
- Faringitis viral: la infección viral es la causa más frecuente de faringitis; Las etiologías incluyen influenza, rinovirus, virus respiratorio sincitial, virus del herpes simple, virus de la inmunodeficiencia humana (VIH) y otros.
- La angina de Vincent: También llamada gingivitis ulcerosa necrosante aguda, es una infección de las encías con dolor de inicio repentino. encías sangrantes, embotamiento de las papilas interdentales y un lecho necrótico ulcerativo de la encía.
- Candidiasis oral: las manifestaciones clínicas de la candidiasis oral consisten en placas blancas en la mucosa bucal, el paladar, la lengua o la orofaringe. Los pacientes pueden tener pérdida del gusto y dolor al comer o tragar. El diagnóstico se confirma mediante la visualización de levadura en gemación en una tinción de Gram o hidróxido de potasio.
- Infección por Corynebacterium ulcerans: C. ulcerans es principalmente un patógeno zoonótico pero tiene el potencial de elaborar toxina diftérica y causar una faringitis exudativa en humanos que es indistinguible de C. diphtheriae.
- Infección por Corynebacterium hemolyticum: C. hemolyticum se asocia con faringitis, a veces acompañada de una erupción maculopapular o escarlatiniforme. También se ha descrito la faringitis membranosa que imita la difteria causada por C. hemolyticum. Otras manifestaciones clínicas incluyen absceso periamigdalino y endocarditis.
Tratamiento de la Difteria
El tratamiento de la difteria respiratoria consiste en antibióticos y antitoxina diftérica para casos graves. El manejo de las vías respiratorias es importante debido al riesgo de obstrucción. Además, los pacientes deben monitorearse con electrocardiogramas seriados y mediciones de enzimas cardíacas que reflejen la intensidad del daño miocárdico. El estado neurológico también debe ser monitoreado cuidadosamente.
Los pacientes con difteria respiratoria deben colocarse en aislamiento y se deben tomar precauciones de contacto para la enfermedad cutánea. El aislamiento debe continuarse hasta que dos cultivos consecutivos tomados con al menos 24 horas de diferencia sean negativos. El tratamiento de la difteria cutánea consiste en antibióticos y por lo general no se necesita antitoxina debido a la ausencia de pseudomembranas o afectación cardíaca.
Antitoxina Diftérica
Se trata de un antisuero hiperinmune producido en caballos que se une a la toxina diftérica y la inactiva. La antitoxina solo es efectiva antes de que la toxina ingrese a la célula y, por tanto, debe administrarse precozmente. Hay aproximadamente un 10% de riesgo de hipersensibilidad y/o enfermedad del suero. Antes de la administración intravenosa de antitoxina, deben realizarse pruebas de sensibilidad al suero de caballo de acuerdo con las instrucciones proporcionadas con el material. La epinefrina debe estar a la mano debido a la posibilidad de anafilaxia. La dosis de antitoxina depende del sitio y la gravedad de la infección.
La Academia Estadounidense de Pediatría recomienda de 20,000 a 40,000 unidades para enfermedad faríngea/laríngea de menos de 48 horas de duración, 40,000 a 60,000 unidades para enfermedad nasofaríngea y 80,000 a 120,000 unidades para más de 3 días de enfermedad o edema difuso del cuello (“cuello de toro”) . La dosis debe administrarse por vía intravenosa durante 60 minutos para desactivar la toxina rápidamente.
Antibioticoterapia
El tratamiento con antibiótico tiene tres beneficios principales: elimina al patógeno y así evita que se forme más toxina, retrasa la propagación de la infección local y reduce la transmisión. Los antibióticos de elección son la eritromicina (500 mg. c. 6 hrs. durante 14 días) o la penicilina G procaína (300,000 unidades cada 12 horas para pacientes ≤ 10 kg y 600,000 unidades cada 12 horas para pacientes> 10 kg IM.) hasta que el paciente pueda tomar medicamentos orales y seguido de penicilina V oral (250 mg. c. 6 hrs.) para un esquema de tratamiento total de 14 días. La eritromicina es de elección debido a su mayor eficacia en comparación con la penicilina.
Se deben obtener cultivos al menos dos semanas después de completar el tratamiento para asegurar la erradicación del patógeno. En el contexto de resistencia a los antibióticos, la vancomicina o linezolid son alternativas razonables. Los resultados del antibiograma deben usarse para adaptar el tratamiento a las circunstancias individuales del paciente.
Intubación del Paciente
La falla respiratoria debido al compromiso de la vía aérea es una complicación importante de la difteria y es una causa importante de mortalidad. En pacientes gravemente enfermos con formación extensa de pseudomembrana, estridor o el tóxico “cuello de toro” de la difteria, debe anticiparse la insuficiencia respiratoria y manejarse de manera agresiva. La intubación puede ayudar a proteger las vías respiratorias, aunque con frecuencia este es un procedimiento difícil en pacientes con difteria debido a edema extenso de las vías respiratorias y friabilidad de la mucosa; también existe el riesgo de desprendimiento inadvertido de la pseudomembrana. Idealmente, la intubación debe ser realizada por profesionales experimentados teniendo respaldo quirúrgico para la traqueotomía y manejo definitivo de la vía aérea.
Seguimiento del Paciente y Profilaxis
Se deben indicar cultivos de seguimiento a las 24 a 48 horas y dos semanas después de la infección. El aislamiento debe continuarse hasta que dos cultivos consecutivos tomados con al menos 24 horas de diferencia sean negativos. Los pacientes deben recibir inmunización con toxoide diftérico durante su convalecencia ya que la infección natural no induce inmunidad.
Los contactos cercanos incluyen familiares y otras personas con antecedentes de contacto directo con el paciente (por ejemplo, cuidadores o amigos que regularmente visiten el hogar), así como también personal médico expuesto a secreciones orales o respiratorias de un paciente con difteria. Los contactos cercanos deben ser identificados, tomarles muestras para cultivo y considerarlos para la profilaxis antimicrobiana. Si las inmunizaciones no están vigentes o incompletas, se debe administrar inmunización con toxoide diftérico.
Después de obtener los cultivos, los contactos deben tratarse con una sola dosis de penicilina G benzatínica (600,000 unidades IM para individuos <6 años de edad y 1.2 millones de unidades IM para individuos ≥ 6 años de edad) o eritromicina oral (500 mg. c. 6 hrs. durante 7 a 10 días).
Referencias Bibliográficas
Bostock AD, Gilbert FR, Lewis D, Smith DC. Corynebacterium ulcerans infection associated with untreated milk. J Infect 1984; 9:286.
Miller LW, Older JJ, Drake J, Zimmerman S. Diphtheria immunization. Effect upon carriers and the control of outbreaks. Am J Dis Child 1972; 123:197.
Kalapothaki V, Sapounas T, Xirouchaki E, et al. Prevalence of diphtheria carriers in a population with disappearing clinical diphtheria. Infection 1984; 12:387.
Zingher A. The Schick test performed on more than 150,000 children in public and parochial schools in New York (Manhattan and the Bronx). Am J Dis Child 1923; 25:392.
Wilson AP. The return of Corynebacterium diphtheriae: the rise of non-toxigenic strains. J Hosp Infect 1995; 30 Suppl:306.
McQuillan GM, Kruszon-Moran D, Deforest A, et al. Serologic immunity to diphtheria and tetanus in the United States. Ann Intern Med 2002; 136:660.
Advisory Committee on Immunization Practices. Recommended adult immunization schedule: United States, 2010. Ann Intern Med 2010; 152:36.
World Health Organization. Immunization, Vaccines and Biologicals: Diptheria.
World Health Organization. Diphtheria detected in Spain.
European Centre for Disease Prevention and Control. Rapid Risk Assessment: A case of diptheria in Spain, 15 June 2015.
Tiwari TS, Golaz A, Yu DT, et al. Investigations of 2 cases of diphtheria-like illness due to toxigenic Corynebacterium ulcerans. Clin Infect Dis 2008; 46:395.
Taylor J, Saveedra-Campos M, Harwood D, et al. Toxigenic Corynebacterium ulcerans infection in a veterinary student in London, United Kingdom, May 2010. Euro Surveill 2010; 15.
Nakao H, Pruckler JM, Mazurova IK, et al. Heterogeneity of diphtheria toxin gene, tox, and its regulatory element, dtxR, in Corynebacterium diphtheriae strains causing epidemic diphtheria in Russia and Ukraine. J Clin Microbiol 1996; 34:1711.
Galazka AM, Robertson SE. Diphtheria: changing patterns in the developing world and the industrialized world. Eur J Epidemiol 1995; 11:107.
Galazka AM, Robertson SE, Oblapenko GP. Resurgence of diphtheria. Eur J Epidemiol 1995; 11:95.
FREEMAN VJ. Studies on the virulence of bacteriophage-infected strains of Corynebacterium diphtheriae. J Bacteriol 1951; 61:675.
Choe S, Bennett MJ, Fujii G, et al. The crystal structure of diphtheria toxin. Nature 1992; 357:216.
Naglich JG, Rolf JM, Eidels L. Expression of functional diphtheria toxin receptors on highly toxin-sensitive mouse cells that specifically bind radioiodinated toxin. Proc Natl Acad Sci U S A 1992; 89:2170.
Naglich JG, Metherall JE, Russell DW, Eidels L. Expression cloning of a diphtheria toxin receptor: identity with a heparin-binding EGF-like growth factor precursor. Cell 1992; 69:1051.
Wong TP, Groman N. Production of diphtheria toxin by selected isolates of Corynebacterium ulcerans and Corynebacterium pseudotuberculosis. Infect Immun 1984; 43:1114.
NAIDITCH MJ, BOWER AG. Diphtheria; a study of 1,433 cases observed during a ten-year period at the Los Angeles County Hospital. Am J Med 1954; 17:229.
Kadirova R, Kartoglu HU, Strebel PM. Clinical characteristics and management of 676 hospitalized diphtheria cases, Kyrgyz Republic, 1995. J Infect Dis 2000; 181 Suppl 1:S110.
Lumio JT, Groundstroem KW, Melnick OB, et al. Electrocardiographic abnormalities in patients with diphtheria: a prospective study. Am J Med 2004; 116:78.
Kneen R, Nguyen MD, Solomon T, et al. Clinical features and predictors of diphtheritic cardiomyopathy in Vietnamese children. Clin Infect Dis 2004; 39:1591.
Jayashree M, Shruthi N, Singhi S. Predictors of outcome in patients with diphtheria receiving intensive care. Indian Pediatr 2006; 43:155.
Dobie RA, Tobey DN. Clinical features of diphtheria in the respiratory tract. JAMA 1979; 242:2197.
Wilson AP, Efstratiou A, Weaver E, et al. Unusual non-toxigenic Corynebacterium diphtheriae in homosexual men. Lancet 1992; 339:998.
Tiley SM, Kociuba KR, Heron LG, Munro R. Infective endocarditis due to nontoxigenic Corynebacterium diphtheriae: report of seven cases and review. Clin Infect Dis 1993; 16:271.
Gruner E, Opravil M, Altwegg M, von Graevenitz A. Nontoxigenic Corynebacterium diphtheriae isolated from intravenous drug users. Clin Infect Dis 1994; 18:94.
Moore LS, Leslie A, Meltzer M, et al. Corynebacterium ulcerans cutaneous diphtheria. Lancet Infect Dis 2015; 15:1100.
Höfler W. Cutaneous diphtheria. Int J Dermatol 1991; 30:845.
Lowe CF, Bernard KA, Romney MG. Cutaneous diphtheria in the urban poor population of Vancouver, British Columbia, Canada: a 10-year review. J Clin Microbiol 2011; 49:2664.
Bray JP, Burt EG, Potter EV, et al. Epidemic diphtheria and skin infections in Trinidad. J Infect Dis 1972; 126:34.
Sing A, Heesemann J. Imported cutaneous diphtheria, Germany, 1997-2003. Emerg Infect Dis 2005; 11:343.
Zeegelaar JE, Faber WR. Imported tropical infectious ulcers in travelers. Am J Clin Dermatol 2008; 9:219.
de Benoist AC, White JM, Efstratiou A, et al. Imported cutaneous diphtheria, United Kingdom. Emerg Infect Dis 2004; 10:511.
Harnisch JP, Tronca E, Nolan CM, et al. Diphtheria among alcoholic urban adults. A decade of experience in Seattle. Ann Intern Med 1989; 111:71.
Farizo KM, Strebel PM, Chen RT, et al. Fatal respiratory disease due to Corynebacterium diphtheriae: case report and review of guidelines for management, investigation, and control. Clin Infect Dis 1993; 16:59.
Efstratiou A, Engler KH, Mazurova IK, et al. Current approaches to the laboratory diagnosis of diphtheria. J Infect Dis 2000; 181 Suppl 1:S138.
Colman G, Weaver E, Efstratiou A. Screening tests for pathogenic corynebacteria. J Clin Pathol 1992; 45:46.
Efstratiou A, Engler KH, Dawes CS, Sesardic D. Comparison of phenotypic and genotypic methods for detection of diphtheria toxin among isolates of pathogenic corynebacteria. J Clin Microbiol 1998; 36:3173.
Komiya T, Shibata N, Ito M, et al. Retrospective diagnosis of diphtheria by detection of the Corynebacterium diphtheriae tox gene in a formaldehyde-fixed throat swab using PCR and sequencing analysis. J Clin Microbiol 2000; 38:2400.
Engler KH, Efstratiou A. Rapid enzyme immunoassay for determination of toxigenicity among clinical isolates of corynebacteria. J Clin Microbiol 2000; 38:1385.
Tiwari TS, Golaz A, Yu DT, et al. Investigations of 2 cases of diphtheria-like illness due to toxigenic Corynebacterium ulcerans. Clin Infect Dis 2008; 46:395.
Kovatch AL, Schuit KE, Michaels RH. Corynebacterium hemolyticum peritonsillar abscess mimicking diphtheria. JAMA 1983; 249:1757.
American Academy of Pediatrics. Red Book: 2018 Report of the Committee on Infectious Diseases, 31st ed, Kimberlin DW, Brady MT, Jackson MA, Long SS (Eds), American Academy of Pediatrics, Itasca, IL 2018.
Park WH, Atkinson JP. THE RELATION OF THE TOXICITY OF DIPHTHERIA TOXIN TO ITS NEUTRALIZING VALUE UPON ANTITOXIN AT DIFFERENT STAGES IN THE GROWTH OF CULTURE. J Exp Med 1898; 3:513.
Kneen R, Pham NG, Solomon T, et al. Penicillin vs. erythromycin in the treatment of diphtheria. Clin Infect Dis 1998; 27:845.
Miller LW, Bickham S, Jones WL, et al. Diphtheria carriers and the effect of erythromycin therapy. Antimicrob Agents Chemother 1974; 6:166.
Engler KH, Warner M, George RC. In vitro activity of ketolides HMR 3004 and HMR 3647 and seven other antimicrobial agents against Corynebacterium diphtheriae. J Antimicrob Chemother 2001; 47:27.





