Disfagia Esofágica Muscular Continua y Acalasia Cricofaríngea.
La disfagia está definida como la dificultad para la deglución. Existen dos tipos: la disfagia orofaríngea o alta y la esofágica o baja. A continuación revisaremos las generalidades de la disfagia, así como lo esencial de la acalasia cricofaríngea, la disfagia esofágica muscular continua y el espasmo esofágico difuso para mantenerte actualizado en tu práctica clínica.
Generalidades de la Disfagia
La disfagia orofaríngea o alta involucra al esfínter esofágico superior (EES) y a la porción cervical del esófago. El paciente refiere dificultad o incapacidad para la deglución al no poder propulsar el bolo alimenticio desde la faringe, a través del EES y hacia el cuerpo esofágico. Ello puede ocasionar aspiración traqueobronquial, la complicación más frecuente y con elevada mortalidad, así como regurgitación nasofaríngea. La disfagia orogaríngea puede ser secundaria a daño neurológico del centro de la deglución, del núcleo motor que controla los músculos estriados de la hipofaringe y esófago superior, o a un trastorno muscular.
La patología que más frecuentemente ocasiona disfagia orofaríngea alta es el evento cerebrovascular. Sin embargo, existen otros padecimientos como la enfermedad de Parkinson, la acalasia cricofaríngea (ver a continuación), distrofias musculares, miastenia gravis, las miopatías, neoplasias, membranas congénitas o adquiridas, lesiones estructurales inflamatorias locales (como la tuberculosis o los abscesos) o aquellas que producen compresión extrínseca o alteración intrínseca de la motilidad.
Disfagia Esofágica o Baja
Por el contrario, la disfagia esofágica o baja es la dificultad que refiere el paciente para deglutir una vez que el bolo alimenticio ha atravesado la faringe y el EES. La disfagia baja se divide, a su vez, en mecánica y motora. La mecánica u obstructiva sucede cuando existe dificultad para pasar el bolo alimenticio a través del esófago debido a una barrera física. Ello puede deberse a un bolo alimenticio muy grande, estrechamiento intrínseco del esófago o a la compresión extrínseca. En este contexto, deberás considerar siempre al cáncer como probable causa.
Por último, la disfagia motora es ocasionada por una alteración en la peristalsis fisiológica del esófago o por alteración en la relajación de los esfínteres esofágicos superior y/o inferior. Considera a la esclerodermia y la diabetes mellitus como probables causas. Tanto la disfagia mecánica como la motora pueden ser intermitentes o continuas. La intermitente ocurre sólo en algunas degluciones, mientras que la continua aparece siempre. Considera a la
Acalasia Cricofaríngea o Disfagia Orofaríngea
La acalasia cricofaríngea se caracteriza por la falta de relajación del músculo cricofaríngeo durante la deglución, sin evidencia de alguna causa neurológica o muscular. La acalasia cricofaríngea se presenta en pacientes mayores de 60 años, apareciendo de manera aislada o asociada a un divertículo de Zenker. Llega a presentarse en pacientes con distrofia muscular oculofaríngea. El cuadro se caracteriza por disfagia orofaríngea, con aspiración traquebronquial en los casos más graves, así como regurgitación nasal. En los estudios de imagen baritados aparece una indentación prominente en la pared posterior de la faringe.
El tratamiento de la acalasia cricofaríngea consiste en la miotomía cricofaríngea en los casos más graves. Se debe descartar previamente reflujo gastroesofágico, dado que, de presentarse esta entidad, estaría contraindicado el procedimiento. Una alternativa en dichos casos es la ditalación endoscópica con balón.
Disfagia Esofágica Muscular Continua (Acalasia)
La acalasia se caracteriza por una mala relajación del esfinter esofágico inferior (EEI). El EEI ocasiona una obstrucción funcional del esófago con los consiguientes síntomas de disfagia, regurguitación, dolor torácico y pérdida de peso. La acalasia se clasifica de la siguiente manera:
- Tipo I o clásica
- De tipo II o vigorosa
- Tipo III o espástica
En la acalasia primaria existen alteraciones musculares y nerviosas, siendo éstas últimas la de mayor relevancia. Existe una disminución importante de los cuerpos neuronales de los plexos mientéricos, principalmente de las neuronas inhibidoras. Sin embargo, se han identificado igualmente alteraciones del nervio vago, su núcleo dorsal y en el tronco encefálico. En la acalasia vigorosa las alteraciones suelen ser más leves.
Así se presenta tu paciente
La edad de presentación es entre los 30 y 50 años de edad, sin predilección por género. El cuadro consta de disfagia, tanto para sólidos como líquidos, dolor torácico a menudo desencadenado por la ingesta y regurguitación. La disfagia es, desde el inicio del padecimiento, tanto para sólidos como para líquidos y progresiva. El paciente va a referir pérdida de peso de meses o años de evolución. Cabe resaltar que la presencia de reflujo gastroesofágico hace poco probable el diagnóstico de acalasia.
Estudios que te serán de utilidad
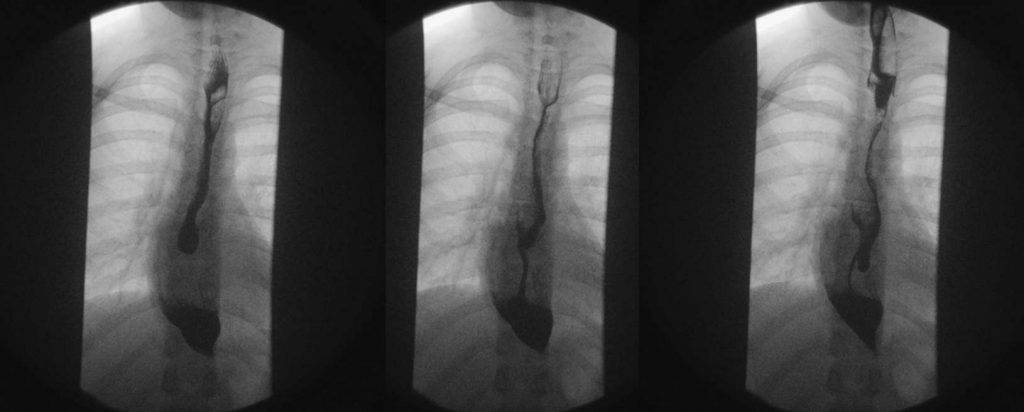
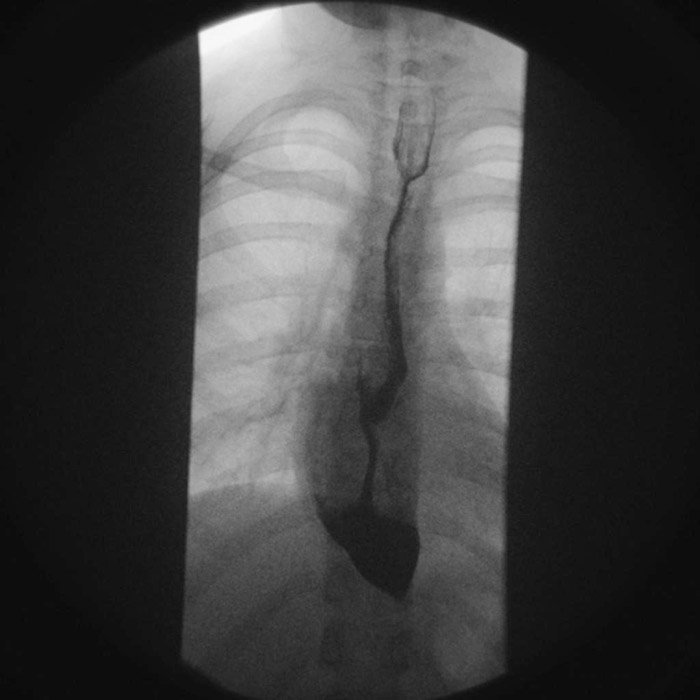
En una radiografía de tórax esperarías encontrar ausencia de burbuja gástrica y mediastino ensanchado. A diferencia del ensanchamiento mediastínico de origen vascular, el de la acalasia se caracteriza por la presencia de nivel hidroaéreo a la bipedestación. Sin embargo, los tres estudios clave a realizar para la evaluación del paciente con probable acalasia son la serie (baritada) esofagogastroduodenal (EGD), endoscopía en el diagnóstico diferencial y la manometría de alta resolución como el estudio confirmatorio o gold estándar.
En la serie EGD podrás evidenciar la presencia de dilatación esofágica, observando mayor dilatación en la porción distal. La columna de bario se torna más delgada distalmente hasta la localización del esfinter no relajado. A dicho patrón se le conoce como “imagen en pico de pájaro”, clásica de la acalasia. Indica siempre una endoscopía para descartar otras causas de pseudoacalasia y evaluar la integridad esofágica.
Manometría de Alta Resolución
Como ya mencionamos, la manometría de alta resolución es el estudio confirmatorio de la acalasia, además de permitir su clasificación. En la acalasia tipo I o clásica no se visualiza actividad motora esofágica, la presión integrada de relajación (IRP) es mayor a 15 mmHg y existe ausencia de peristalsis en el 100% de las contracciones, con una integral de contractilidad distal (DCI) < 100 mmHg/s/cm. En la acalasia vigorosa o de tipo II la mediana de IRP es mayor a 15 mmHg, existe un 100% de peristalsis fallida, además de una presurización panesofágica mayor o igual al 20% de las degluciones.
Por último, en la tipo III o espástica la IRP es igualmente mayor a 15 mmHg, el 100% de la peristalsis es anormal, es decir, conservada en la porción distal o existen contracciones prematuras (espásticas) con una DCI > 450 mmHg/s/cm en 20% o más de las degluciones. El clasificar la acalasia permite determinar el tratamiento a seguir. La acalasia clásica tiene una mayor tasa de respuesta a la miotomía de Heller en comparación a la dilatación con balón, la vigorosa responde a a ambos tratamientos, mientras que la espástica tiene pobre respuesta a cualquiera de ellos.
Pseudoacalasia o Acalasia Secundaria
La pseudoacalasia o acalasia secundaria se asocia en un 75% a neoplasias, principalmente al adenocarcinoma gástrico. Otros padecimientos relacionados son el linfoma, la enfermedad de Chagas (por Tripanosoma cruzi), la amiloidosis, complicaciones postvagotomía, pseudoobstrucción intestinal crónica idiopática, radiación, sustancias tóxicas o fármacos.
Tratamiento de la Acalasia
Desafortunadamente, la degeneración nerviosa del plexo mientérico no puede tratarse. Por tanto, el manejo se enfoca en mejorar la sintomatología y prevenir las complicaciones del padecimiento. Actualmente se hace uso de la dilatación endoscópica con balón, farmacoterapia, la inyección de toxina botulínica y la intervención quirúrgica. Al final del día, lo que se busca es disminuir la presión del EEI, así como mejorar el vaciamiento del esófago por gravedad.
Miotomía de Heller
Los pacientes con mayor tasa de respuesta a este procedimiento son los que padecen acalasia clásica (95%). Se considera el tratamiento de elección en pacientes jóvenes con bajo riesgo quirúrgico, pacientes con mala respuesta a la dilatación endoscópica y aquellos que no son candidatos a la dilatación por alto riesgo de perforación. La complicación temprana más frecuente de la miotomía de Heller es la neumonía y la tardía el reflujo gastroesofágico. Este procedimiento consta de la sección de las fibras musculares lisas del tercio distal esofágico, comprendiendo 5 a 7 cm en esófago y 3 cm en estómago. La técnica de elección es la laparosópica, con una tasa de fallo del 6.7% debido a miotomía incompleta.
Debido al riesgo de reflujo gastroesofágico como complicación, la miotomía se asocia a funduplicatura de Toupet como técnica antirreflujo. La tasa de éxito inicial es del 90%, con resultados similares a los 12 y 36 meses. En pacientes con acalasia tipo III o espástica se realiza POEM o miotomía endoscópica peroral. Se realiza una miotomía más extensa de 15 cm. La resección esofágica y sustitución por estómago tubulizado es el tratamiento definitivo de la acalasia. Esta técnica está indicada cuando ha habido fracaso de las demás intervenciones, en la estenosis no dilatable o en pacientes con megaesófago (sigmoide).
Dilatación Endoscópica con Balón
Es el tratamiento de elección en caso de no realizarse la intervención quirúrgica por decisión del paciente o contraindicación. Los pacientes con el mejor pronóstico para este procedimiento son aquellos mayores de 40 años, mujeres, pacientes con diámetro esofágico angosto y aquellos con acalasia vigorosa (tipo II). Es efectiva de manera inicial en un 85% de los casos. Sin embargo, a largo plazo tiene resultados inferiores a la miotomía, con una incidencia de complicaciones y mortalidad similar. Además, el antecedente de dilataciones previas dificulta la cirugía.
Se prefiere la dilatación neumática gradual, con una tasa de éxito del 93% a los 4 años. Si posterior a 3 dilataciones no se ha logrado mejoría, se sugiere la miotomía. Las principales complicaciones son la perforación y la hemorragia. Las contraindicaciones relativas son un esófago sigmoide, miotomía previa, presencia de divertículo epifrénico o una gran hernia de hiato.
Toxina Botulínica
Se realiza una inyección de toxina botulínica vía endoscópica en el EEI y se indica en pacientes con alto riesgo quirúrgico y que no han respondido a la dilatación endoscópica. Este procedimiento ocasiona un proceso inflamatorio de la mucosa esofágica con aumento del riesgo de perforación. Su efectividad inicial es del 85%, 50% a los 6 meses y de 30% al año del procedimiento.
Tratamiento farmacológico
Se indican en pacientes que no son candidatos a ningún otro tipo de tratamiento y de manera temporal, principalmente en niños y ancianos. Se indican relajantes de músculo liso, pudiendo hacer uso de nitratos o un calcioantagonista como el nifedipino. El dinitrato de isosorbide tiene una mayor eficacia que el nifedipino; sin embargo, conlleva una mayor cantidad de efectos secundarios, principalmente cefalea.
Complicaciones de la Acalasia
Puede presentarse una esofagitis secundaria a la irritación por alimentos o sobreinfección, particularmente por Candida spp. En hasta 30% de los pacientes habrá presencia de regurgitación con elevado riesgo de aspiración traqueobronquial. Por último, el riesgo de carcinoma esofágico es del 2 al 7% en pacientes con acalasia, siendo más frecuente en pacientes no tratados o parcialmente tratados.
Espasmo Esofágico Difuso
El espasmo esofágico difuso se caracteriza por múltiples contracciones, espontáneas o inducidas por la deglución, que ocurren de manera simultánea, de gran amplitud, larga duración y repetitivas. Esta entidad puede presentarse de manera aislada o asociarse a otras patologías, tales como la neuropatía diabética, esofagitis por reflujo, colagenosis, esofagitis por radiación, obstrucción esofágica, entre otras. La alteración en el espasmo esofágico difuso consiste, en contraste con la acalasia, en la degeneración segmentaria del nervio, más que de los cuerpos neuronales. La edad de presentación ronda los 40 años y puede progresar a acalasia tipo III. El cuadro clínico del espasmoe sofágico difuso se caracteriza por dolor torácico y disfagia, tanto para sólidos como líquidos, es intermitente, no es progresiva, varía a lo largo del día y no ocasiona pérdida de peso.
El dolor del espasmo esofágico difuso normalmente es retroesternal y se presenta en reposo, durante la deglución o en situaciones de estrés. También puede haber pirosis y no asocia reflujo gastroesofágico. Al igual que en la acalasia, en la evaluación del espasmo esofágico difuso se realiza una serie esofagogastroduodenal (imagen clásica de “esófago en sacacorchos”), endoscopia y manometría. La principal diferencia con la acalasia en este último estudio es la relajación del esfinter esofágico inferior. El tratamiento es farmacológico y consiste en nitroglicerina sublingual o nifedipino. En pacientes que no responden a estos medicamentos, se puede realizar una dilatación con balón de la porción esofágica inferior, en particular en aquellos que refieren disfagia. La última opción, ante el fracaso de las medidas anteriores, es la miotomía de Heller.
Referencias Bibliográficas
Vaezi MF, Pandolfino JE, Vela MF. ACG clinical guideline: diagnosis and management of achalasia. Am J Gastroenterol 2013; 108:1238.
Spechler SJ. American gastroenterological association medical position statement on treatment of patients with dysphagia caused by benign disorders of the distal esophagus. Gastroenterology 1999; 117:229.
Boeckxstaens GE, Zaninotto G, Richter JE. Achalasia. Lancet 2014; 383:83.
Boeckxstaens GE, Annese V, des Varannes SB, et al. Pneumatic dilation versus laparoscopic Heller’s myotomy for idiopathic achalasia. N Engl J Med 2011; 364:1807.
Vela MF, Richter JE, Khandwala F, et al. The long-term efficacy of pneumatic dilatation and Heller myotomy for the treatment of achalasia. Clin Gastroenterol Hepatol 2006; 4:580.
Rohof WO, Salvador R, Annese V, et al. Outcomes of treatment for achalasia depend on manometric subtype. Gastroenterology 2013; 144:718.
Vantrappen G, Hellemans J, Deloof W, et al. Treatment of achalasia with pneumatic dilatations. Gut 1971; 12:268.
Vaezi MF, Baker ME, Achkar E, Richter JE. Timed barium oesophagram: better predictor of long term success after pneumatic dilation in achalasia than symptom assessment. Gut 2002; 50:765.
Pandolfino JE, Kwiatek MA, Nealis T, et al. Achalasia: a new clinically relevant classification by high-resolution manometry. Gastroenterology 2008; 135:1526.
Hulselmans M, Vanuytsel T, Degreef T, et al. Long-term outcome of pneumatic dilation in the treatment of achalasia. Clin Gastroenterol Hepatol 2010; 8:30.
Elliott TR, Wu PI, Fuentealba S, et al. Long-term outcome following pneumatic dilatation as initial therapy for idiopathic achalasia: an 18-year single-centre experience. Aliment Pharmacol Ther 2013; 37:1210.
Campos GM, Vittinghoff E, Rabl C, et al. Endoscopic and surgical treatments for achalasia: a systematic review and meta-analysis. Ann Surg 2009; 249:45.
Morino M, Rebecchi F, Festa V, Garrone C. Preoperative pneumatic dilatation represents a risk factor for laparoscopic Heller myotomy. Surg Endosc 1997; 11:359.
Vantrappen G, Hellemans J. Treatment of achalasia and related motor disorders. Gastroenterology 1980; 79:144.
Hunter JG, Trus TL, Branum GD, Waring JP. Laparoscopic Heller myotomy and fundoplication for achalasia. Ann Surg 1997; 225:655.
Vogt D, Curet M, Pitcher D, et al. Successful treatment of esophageal achalasia with laparoscopic Heller myotomy and Toupet fundoplication. Am J Surg 1997; 174:709.
Ancona E, Anselmino M, Zaninotto G, et al. Esophageal achalasia: laparoscopic versus conventional open Heller-Dor operation. Am J Surg 1995; 170:265.
Holzman MD, Sharp KW, Ladipo JK, et al. Laparoscopic surgical treatment of achalasia. Am J Surg 1997; 173:308.
Arreola-Risa C, Sinanan M, Pellegrini CA. Thoracoscopic Heller’s myotomy. Treatment of achalasia by the videoendoscopic approach. Chest Surg Clin N Am 1995; 5:459.





