Infarto Renal: Breve Revisión de la Enfermedad Renovascular.

Revisamos de manera breve y concisa las principales entidades que abarca la enfermedad renovascular, incluyendo al infarto renal, la ateroembolia renal, la trombosis venosa renal y la nefroesclerosis hipertensiva. La hipertensión renovascular la abordamos por separado.
Las dos principales causas del infarto renal son la tromboembolia, que generalmente se origina a partir de un trombo en el corazón o la aorta, y la trombosis in situ, que puede causar la oclusión completa de la arteria renal principal o una rama segmentaria. Las manifestaciones renales son diferentes en la ateroembolia, que, debido a que los émbolos suelen ser rígidos, de forma irregular y de mucho menor tamaño, tienden a producir una oclusión arterial incompleta de vasos más distales, con atrofia isquémica secundaria en lugar de infarto renal.
Las principales causas de infarto renal incluyen enfermedad cardioembólica, lesión de la arteria renal y estados de hipercoagulabilidad. El infarto renal es más común en pacientes con fibrilación auricular. Otras etiologías menos comunes asociadas a lesión de la arteria renal, incluyen la displasia fibromuscular, síndrome de Ehlers-Danlos, mediolisis arterial segmentaria (SAM), oclusión de la arteria renal después de una intervención aórtica o renal endovascular y el consumo de cocaína.
La edad media de presentación difiere según la etiología subyacente: cardiogénica (65 años), lesión de la arteria renal (43 años), estado de hipercoagulabilidad (62 años) e idiopática (49.5 años). Los pacientes en el grupo cardiogénico presentan con mayor frecuencia antecedentes de hipertensión, diabetes mellitus, enfermedad cardiovascular (ECV), valvulopatías y fibrilación auricular que sus homólogos en los otros tres grupos.
Así se presenta tu paciente
Los pacientes con un infarto renal agudo generalmente refieren aparición aguda de dolor en el flanco o dolor abdominal generalizado, frecuentemente acompañado de náuseas, vómitos y, ocasionalmente, fiebre. Estos hallazgos pueden estar acompañados por una elevación aguda de la presión arterial probablemente mediada por liberación de renina. Se pueden observar signos de embolización extrarrenal, como déficits neurológicos focales e isquemia mesentérica y de extremidades. En raras ocasiones, la evidencia angiográfica del infarto renal es un hallazgo incidental en pacientes sin antecedentes previos que sugieran tal evento.
Estudios que serán de utilidad
En pacientes con riesgo de embolización sistémica y que presenten síntomas sugerentes de infarto renal, se recomienda solicitar las siguientes pruebas de laboratorio:
- Biometría hemática completa con diferencial.
- Creatinina sérica y lactato deshidrogenasa (LDH)
- Examen general de orina (EGO) y urocultivo.
- Electrocardiograma para evaluar fibrilación auricular.
En el EGO se puede encontrar hematuria (32%) y proteinuria (12%). La elevación media de creatinina sérica suele ser < 1 mg/dl y la TFG media de 75.9±25.8 mL/min. La reducción de la TFG es mayor en pacientes con enfermedad bilateral o un émbolo grande y unilateral. Sin embargo, muchos pacientes con infarto renal tienen enfermedad vascular subyacente, por lo que la reserva funcional renal es limitada, de manera que incluso un infarto pequeño puede causar un aumento de la creatinina.
En el contexto clínico apropiado, una LDH sérica elevada (a menudo más de dos a cuatro veces el límite superior de lo normal) con poco o ningún aumento en las aminotransferasas séricas es muy sugerente de infarto renal. Otros hallazgos inespecíficos son una leucocitosis moderada y PCR elevada.
Estudios de Imagen en el Infarto Renal
La tomografía computarizada (TAC) helicoidal (sin contraste) suele ser la prueba inicial preferida para evaluar el dolor en el flanco, ya que es el estándar de oro para el diagnóstico de litiasis renal y ureteral, que son mucho más comunes que el infarto renal. Si no hay evidencia de litiasis en la TAC helicoidal no contrastada, se debe realizar una tomografía computarizada con contraste para evaluar un probable infarto renal. El hallazgo clásico es un defecto de perfusión en forma de cuña.
La resonancia magnética (RM) con gadolinio es una alternativa a la TAC, aunque el uso de gadolinio se ha asociado a fibrosis sistémica nefrogénica en pacientes con insuficiencia renal importante, y su uso puede estar contraindicado en tales pacientes. La evaluación con radioisótopos puede mostrar una disminución segmentaria o generalizada de la perfusión renal. La ecografía es mucho menos sensible.
Tratamiento del Infarto Renal
Las opciones de tratamiento del infarto renal incluyen anticoagulación, terapia endovascular (trombolisis/trombectomía con o sin angioplastia) y cirugía abierta. En pacientes con oclusión aguda de la arteria renal, incluyendo la arteria renal principal o una rama segmentaria, diagnóstico precoz (< 1 a 2 días desde el inicio de los síntomas), así como en pacientes seleccionados con hipertensión persistente, se recomienda terapia endovascular percutánea (trombolisis local, trombectomía, o colocación de stent), a menos que existan contraindicaciones, que son similares a la terapia fibrinolítica en el infarto agudo de miocardio.
Un riñón pequeño en el lado afectado sugiere isquemia crónica y probable formación de circulación colateral, lo que reducirá los probables beneficios de corregir la oclusión de la arteria renal. La isquemia prolongada también reduce la probabilidad de la viabilidad del tejido. En estas circunstancias, la revascularización puede no ser necesaria. Muchos pacientes con infarto renal agudo desarrollan hipertensión arterial durante la primera semana y a menudo requiere tratamiento antihipertensivo. Dado que el aumento de la liberación de renina tiende a desempeñar un papel importante, el tratamiento con un IECA o ARA II puede ser eficaz.
La anticoagulación con heparina IV seguida de warfarina es el esquema de anticoagulación estándar en este contexto. La heparina generalmente se suspende cuando el INR está entre 2 y 3. Sin embargo, en pacientes con fibrilación auricular, un valor entre 2.5 y 3.5 es razonable si el evento ocurrió mientras estaba en tratamiento adecuado con warfarina o si existe un riesgo particularmente elevado (p.e. enfermedad reumática, válvulas protésicas). En el paciente con fibrilación auricular de origen no valvular, los anticoagulantes orales no antagonistas de la vitamina K se prefieren a la warfarina. Se debe tener en cuenta la presencia de insuficiencia renal en la elección del anticoagulante.
Ateroembolia Renal
La embolización de cristales de colesterol, o ateroembolia, se produce cuando partes de una placa aterosclerótica se rompen y se embolizan de forma distal, lo que produce una oclusión total o parcial de múltiples arterias pequeñas que conducen a isquemia tisular u orgánica. La embolización de cristales de colesterol generalmente afecta a pacientes de edad avanzada con aterosclerosis erosiva difusa. A menudo se observa después de la manipulación de la aorta u otras arterias grandes durante la arteriografía, angioplastia o cirugía, pero también puede ocurrir de forma espontánea.
El tratamiento con warfarina, heparina o agentes trombolíticos puede aumentar el riesgo, pero el ateroembolismo asociado a anticoagulantes es poco frecuente. La ateroembolia renal generalmente produce una lesión renal subaguda observada varias semanas o más después de un posible evento desencadenante. También puede haber hipertensión grave. Sin embargo, el aumento de la creatinina sérica no es la presentación más común; más bien, es un hallazgo de la presentación más frecuente, ya que el ateroembolismo es ubicuo y afecta a varios lechos vasculares.
Además, los estudios de laboratorio para evaluar la ateroembolia renal no se realizan de forma rutinaria. Por tanto, la presentación más frecuente es la ateroembolia de la piel (que produce “síndrome del dedo azul del pie” o livedo reticularis), del mesenterio (que produce isquemia intestinal, sangrado gastrointestinal o pancreatitis) y del sistema nervioso central (que produce un ataque isquémico transitorio, confusión, o síntomas visuales). La ateroembolia renal puede producir una disminución aguda de la función renal dentro de la primera o segunda semana después de un evento desencadenante.
Estudios que serán de utilidad
Algunos pacientes presentan hematuria y, rara vez, cilindros hemáticos en el examen general de orina. Otros hallazgos de laboratorio incluyen eosinofilia e hipocomplementemia, posiblemente reflejando la activación inmunológica en la superficie de los émbolos expuestos. Se puede hacer un diagnóstico clínico de ateroembolia renal cuando un posible evento desencadenante (generalmente una angiografía) es seguido por el inicio subagudo de lesión renal (generalmente semanas o más en lugar de horas o días), particularmente cuando hay signos de ateroembolia extrarrenal.
La biopsia renal o cutánea se considera el método definitivo para el diagnóstico. No es necesaria en pacientes con enfermedad renal ateroembólica iatrogénica que presentan todas las siguientes características de la tríada clínica clásica:
- Un evento desencadenante (como angiografía aórtica o coronaria)
- Lesión renal subaguda o aguda
- Hallazgos típicos de la piel, como el síndrome del dedo azul y el livedo reticularis
También se puede diferir una biopsia en pacientes con sospecha de ateroembolia renal si hay presencia de émbolos de colesterol retinianos (placas de Hollenhorst). Al igual que la histología, la fundoscopia puede confirmar el diagnóstico y nunca debe omitirse. Por el contrario, la biopsia renal es esencial para el diagnóstico de casos con una forma crónica y latente de ateroembolia renal. También se requiere en pacientes que presentan una forma espontánea del trastorno.
Diagnóstico Diferencial de la Ateroembolia Renal
El diagnóstico diferencial de la ateroembolia renal posterior a una angiografía o cirugía vascular, incluye principalmente la necrosis tubular aguda (ATN) posterior a isquemia o la inducida por medio de contraste. Estas entidades a menudo se pueden distinguir por la ausencia de embolias extrarrenales y la clínica. El diagnóstico diferencial incluye además a la nefritis tubulointersticial aguda y la vasculitis sistémica, particularmente en pacientes con eosinofilia y/o hipocomplementemia.
Tratamiento de la Ateroembolia Renal
No existe un tratamiento específico para la ateroembolia renal. Todos los pacientes deben recibir un tratamiento agresivo de la enfermedad cardiovascular. Además de las estatinas, el tratamiento incluye aspirina, el control de la presión arterial, el abandono del tabaquismo y, en pacientes con diabetes, el control glucémico. Los pacientes con ateroembolia renal tienen un mal pronóstico general, que en parte refleja la gravedad de la enfermedad vascular subyacente.
Trombosis Venosa Renal
La trombosis venosa renal representa hasta el 20% de todos los casos de trombosis venosa no asociada a catéter vascular en recién nacidos. En los niños, la trombosis venosa renal ocurre con mayor frecuencia como consecuencia del síndrome nefrótico y el trasplante renal. La etiopatogenia incluye un flujo sanguíneo renal reducido, hiperosmolaridad, hipercoagulabilidad y aumento de la viscosidad de la sangre. Los factores de riesgo asociados incluyen prematuridad, hipoxia perinatal, shock, deshidratación, sepsis, policitemia, cardiopatía congénita cianótica y diabetes materna.
Además, hay cada vez mayor evidencia de que los bebés con trombosis venosa renal tienen mayor incidencia de enfermedad protrombótica hereditaria en comparación con la población general. Ello incluye a la mutación del factor V de Leiden, la deficiencia de proteína C o S, la mutación de la metilentetrahidrofolato reductasa (MTHFR) y la elevación de la lipoproteína A. La trombosis venosa renal, que puede ocurrir como una extensión de la trombosis de la vena cava inferior, generalmente presenta una de las siguientes características pivote: masa en flanco, hematuria y/o trombocitopenia. La tríada completa se presenta solo en el 13% de los casos.
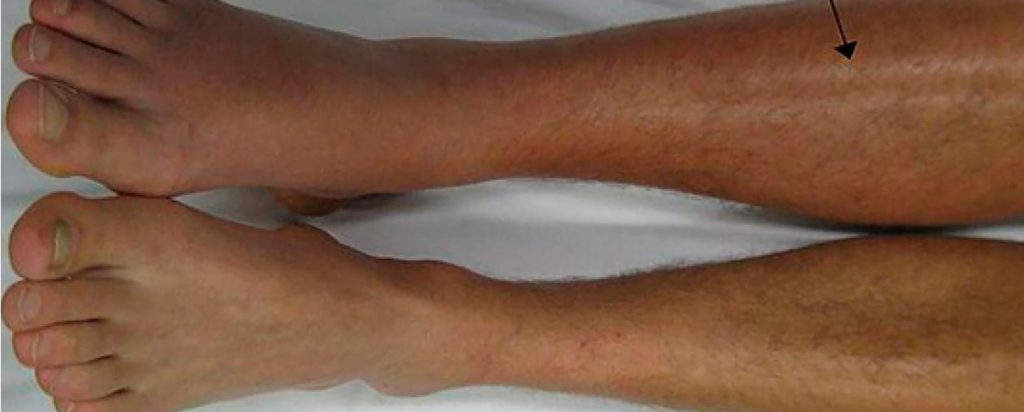
Otros signos y síntomas asociados son anuria, vómitos, hipovolemia y proteinuria. Sin embargo, la trombosis venosa renal a menudo tiene un inicio insidioso y no produce síntomas que puedan referirse al riñón. En este caso, la referencia es un evento tromboembólico, como una tromboembolia pulmonar. Cuando el trombo se extiende desde la vena renal hasta la vena cava inferior, ambas extremidades inferiores pueden tornarse cianóticas y edematosas. El tratamiento consiste en anticoagulación. En los casos de tromboembolismos de repetición, puede ser necesaria la colocación percutánea de un filtro de vena cava inferior desde la yugular.
Nefroesclerosis Hipertensiva
La nefroesclerosis hipertensiva es un trastorno renal asociado a hipertensión crónica. Los factores de riesgo incluyen hipertensión grave y enfermedad renal crónica subyacente, especialmente la nefropatía diabética. Los hallazgos histológicos característicos incluyen lesiones vasculares, glomerulares y tubulointersticiales. Los pacientes tienen el antecedente de hipertensión de larga evolución que suele ir acompañada de retinopatía e hipertrofia ventricular izquierda y que precede al desarrollo de proteinuria o insuficiencia renal. Se acompaña de elevación del BUN y creatinina sérica. La proteinuria suele ser inferior a 1 g/día, aunque pueden ocurrir en rango nefrótico en algunos casos.
Puede observarse también hiperuricemia y la tasa de progresión de la enfermedad renal es generalmente lenta. El diagnóstico de nefroesclerosis hipertensiva generalmente se infiere a partir de las características clínicas características. La confirmación por biopsia renal rara vez está indicada. Se deben excluir otras causas obvias de enfermedad renovascular, especialmente la estenosis bilateral de la arteria renal. Los pacientes con estenosis de la arteria renal son más propensos a tener hipertensión grave o refractaria, o una elevación aguda de la presión arterial con respecto a la basal y previamente estable.
Así como un deterioro relativamente rápido de la función renal debido a oclusión importante de una o ambas arterias renales o a la disminución de la perfusión renal promovida por angiotensina mediante la inhibición con IECAs o ARA II. El tratamiento eficaz de la hipertensión generalmente retarda la progresión de la lesión renal. No está claro si IECAs y ARA II, que son los fármacos de elección para la renoprotección en pacientes con enfermedad renal crónica proteinúrica, también son protectores en pacientes con nefroesclerosis benigna sin proteinuria.
Referencias Bibliográficas
Bourgault M, Grimbert P, Verret C, et al. Acute renal infarction: a case series. Clin J Am Soc Nephrol 2013; 8:392.
Hazanov N, Somin M, Attali M, et al. Acute renal embolism. Forty-four cases of renal infarction in patients with atrial fibrillation. Medicine (Baltimore) 2004; 83:292.
Chu PL, Wei YF, Huang JW, et al. Clinical characteristics of patients with segmental renal infarction. Nephrology (Carlton) 2006; 11:336.
Frost L, Engholm G, Johnsen S, et al. Incident thromboembolism in the aorta and the renal, mesenteric, pelvic, and extremity arteries after discharge from the hospital with a diagnosis of atrial fibrillation. Arch Intern Med 2001; 161:272.
Filippone EJ, Foy A, Galanis T, et al. Segmental arterial mediolysis: report of 2 cases and review of the literature. Am J Kidney Dis 2011; 58:981.
Siablis D, Liatsikos EN, Goumenos D, et al. Percutaneous rheolytic thrombectomy for treatment of acute renal-artery thrombosis. J Endourol 2005; 19:68.
Greenberg JM, Steiner MA, Marshall JJ. Acute renal artery thrombosis treated by percutaneous rheolytic thrombectomy. Catheter Cardiovasc Interv 2002; 56:66.
Siezenga MA, van Overhagen H, van Buren M. [Acute occlusion of the renal artery treated by means of rheolytic thrombectomy]. Ned Tijdschr Geneeskd 2005; 149:2413.
Pellerin O, Garçon P, Beyssen B, et al. Spontaneous renal artery dissection: long-term outcomes after endovascular stent placement. J Vasc Interv Radiol 2009; 20:1024.
Stawicki SP, Rosenfeld JC, Weger N, et al. Spontaneous renal artery dissection: three cases and clinical algorithms. J Hum Hypertens 2006; 20:710.
Bemanian S, Motallebi M, Nosrati SM. Cocaine-induced renal infarction: report of a case and review of the literature. BMC Nephrol 2005; 6:10.
Scolari F, Tardanico R, Zani R, et al. Cholesterol crystal embolism: A recognizable cause of renal disease. Am J Kidney Dis 2000; 36:1089.
Tunick PA, Kronzon I. Atheroembolism. In: Vascular Medicine: A Companion to Braunwald’s Heart Disease, Creager M, Dzau VJ, Loscalzo J (Eds), Elsevier, Philadelphia 2006.
Modi KS, Rao VK. Atheroembolic renal disease. J Am Soc Nephrol 2001; 12:1781.
Fukumoto Y, Tsutsui H, Tsuchihashi M, et al. The incidence and risk factors of cholesterol embolization syndrome, a complication of cardiac catheterization: a prospective study. J Am Coll Cardiol 2003; 42:211.
Scolari F, Ravani P, Gaggi R, et al. The challenge of diagnosing atheroembolic renal disease: clinical features and prognostic factors. Circulation 2007; 116:298.
Scolari F, Ravani P, Pola A, et al. Predictors of renal and patient outcomes in atheroembolic renal disease: a prospective study. J Am Soc Nephrol 2003; 14:1584.
Haas M, Spargo BH, Wit EJ, Meehan SM. Etiologies and outcome of acute renal insufficiency in older adults: a renal biopsy study of 259 cases. Am J Kidney Dis 2000; 35:433.
Tuckuviene R, Christensen AL, Helgestad J, et al. Pediatric venous and arterial noncerebral thromboembolism in Denmark: a nationwide population-based study. J Pediatr 2011; 159:663.
Haddad H, Lee KS, Higgins A, et al. Routine surveillance ultrasound for the management of central venous catheters in neonates. J Pediatr 2014; 164:118.
Rizzi M, Goldenberg N, Bonduel M, et al. Catheter-Related Arterial Thrombosis in Neonates and Children: A Systematic Review. Thromb Haemost 2018; 118:1058.
Narang S, Roy J, Stevens TP, et al. Risk factors for umbilical venous catheter-associated thrombosis in very low birth weight infants. Pediatr Blood Cancer 2009; 52:75.
Venkateswaran L, Scaglia F, McLin V, et al. Ornithine transcarbamylase deficiency: a possible risk factor for thrombosis. Pediatr Blood Cancer 2009; 53:100.
Zigman A, Yazbeck S, Emil S, Nguyen L. Renal vein thrombosis: a 10-year review. J Pediatr Surg 2000; 35:1540.
Avila ML, Pullenayegum E, Williams S, et al. Post-thrombotic syndrome and other outcomes of lower extremity deep vein thrombosis in children. Blood 2016.
Limperger V, Klostermeier UC, Kenet G, et al. Clinical and laboratory characteristics of children with venous thromboembolism and protein C-deficiency: an observational Israeli-German cohort study. Br J Haematol 2014; 167:385.
Toto RB. Hypertensive nephrosclerosis in African Americans. Kidney Int 2003; 64:2331.
Genovese G, Friedman DJ, Ross MD, et al. Association of trypanolytic ApoL1 variants with kidney disease in African Americans. Science 2010; 329:841.
Freedman BI, Iskandar SS, Appel RG. The link between hypertension and nephrosclerosis. Am J Kidney Dis 1995; 25:207.
Harvey JM, Howie AJ, Lee SJ, et al. Renal biopsy findings in hypertensive patients with proteinuria. Lancet 1992; 340:1435.
Zucchelli P, Zuccalà A. Primary hypertension–how does it cause renal failure? Nephrol Dial Transplant 1994; 9:223.
Westhoff JH, Hilgers KF, Steinbach MP, et al. Hypertension induces somatic cellular senescence in rats and humans by induction of cell cycle inhibitor p16INK4a. Hypertension 2008; 52:123.
Jafar TH, Stark PC, Schmid CH, et al. Progression of chronic kidney disease: the role of blood pressure control, proteinuria, and angiotensin-converting enzyme inhibition: a patient-level meta-analysis. Ann Intern Med 2003; 139:244.
Agodoa LY, Appel L, Bakris GL, et al. Effect of ramipril vs amlodipine on renal outcomes in hypertensive nephrosclerosis: a randomized controlled trial. JAMA 2001; 285:2719.
Wright JT Jr, Bakris G, Greene T, et al. Effect of blood pressure lowering and antihypertensive drug class on progression of hypertensive kidney disease: results from the AASK trial. JAMA 2002; 288:2421.